
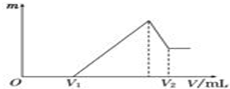
 将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:分析 (1)根据图象可知,在滴加NaOH溶液到体积V1=160mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=160mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,根据Mg原子、Al原子、SO42-离子、Na+离子守恒,列方程求算n(Mg),然后计算出n(Al);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒,求出n(NaOH),再利用V=$\frac{n}{V}$计算滴入氢氧化钠溶液体积V2;
(2)使Mg2+、Al3+刚好完全沉淀,此时生成氢氧化镁、氢氧化铝和硫酸钠,根据硫酸钠的化学式可以计算出氢氧化钠的物质的量,再根据V=$\frac{n}{c}$计算出需要氢氧化钠溶液的体积;
(3)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL2mol•L-1硫酸溶解后,再加入450mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:沉淀达到最大量时消耗400mL氢氧化钠溶液,再加入50mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,求得:Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,据此计算a的范围.
解答 解:(1)当V1=160mL时,此时溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=$\frac{1}{2}$n(Na+)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.16L×1mol/L=0.08mol,
设MgSO4为xmol、Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1,
100mL 2mol/L的H2SO4溶液中含有硫酸的物质的量为:2mol/L×0.1L=0.2mol,
根据SO42-离子守恒有:x+3y=0.2-0.08=0.12,
联立方程解得:x=0.06、y=0.02,
所以金属粉末中:n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol;
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.2mol+0.04mol=0.44mol,
则V2点消耗氢氧化钠溶液的体积为:$\frac{0.44mol}{1mol/L}$=0.44L=440mL,
故答案为:0.06;0.04;440;
(2)使Mg2+、Al3+刚好完全沉淀,此时溶质为硫酸钠,则n(NaOH)=2n(Na2SO4)=0.4mol,加入的NaOH的体积V为:V=$\frac{0.4mol}{1mol/L}$=400mL,
故答案为:400mL;
(3)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL2mol•L-1硫酸溶解后,再加入450mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知镁离子、铝离子恰好完全沉淀时消耗400mL氢氧化钠溶液,再加入50mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3 +NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1,
故答案为:0.5≤a<1.
点评 本题以图象题的形式考查混合物反应的计算、镁铝化合物性质,题目难度中等,分析图象各阶段的发生的反应是解题关键,注意掌握守恒思想在化学计算中的应用方法.


科目:高中化学 来源: 题型:解答题
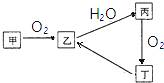 已知甲、乙、丙、丁4种物质均含有常见非金属元素,其中甲为淡黄色粉末.它们之间有如图所示的转化关系(转化过程中部分产物未标出).
已知甲、乙、丙、丁4种物质均含有常见非金属元素,其中甲为淡黄色粉末.它们之间有如图所示的转化关系(转化过程中部分产物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各为0.1 mol的羟基(-OH)和OH-中含有的电子数目均为0.9NA | |
| B. | 标准状况下,22.4 L O2与44.8 L SO2充分反应后转移电子的数目为4NA | |
| C. | 各为0.1 mol的羟基(-OH)和OH-中含有的电子数目均为0.9NA | |
| D. | 1L 0.1 mol/L的NaClO溶液中含有的ClO-离子数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL该溶液中含0.8g NaOH | |
| B. | 200mL该溶液与100mL 0.2 mol/L的硫酸溶液反应形成中性溶液 | |
| C. | 100mL该溶液中约含0.02 mol×6.02×1023mol-1个Na+ | |
| D. | 取NaOH 8g溶于1L水中即得到1L该溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 混合气体的相对分子质量 | D. | C气体的总物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
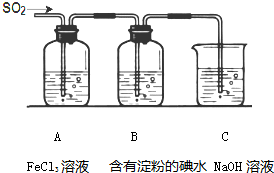 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种元素均可以和氧元素形成2种或2种以上氧化物 | |
| B. | 实验室用铜和浓硝酸反应制取NO | |
| C. | CO2、SO2、NO2都能与H2O反应,且原理相同 | |
| D. | 稀硫酸、稀硝酸与铁的反应均属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下22.4L H2中含有氢分子的个数为2NA | |
| B. | 56g Fe与稀盐酸充分反应时失去的电子数为2NA | |
| C. | 44g CO2中含有氧原子的个数为2NA | |
| D. | 1L 1mol/L NaCl溶液中含有钠离子的个数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com