
A.A、B、C、D B.B、A、C、D
C.D、A、B、C D.B、A、D、C
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
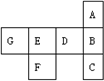 (2010?卢湾区二模)“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77.
(2010?卢湾区二模)“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77.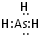
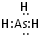
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素 | A | B | C | D |
| 结构性质 信息 |
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 | 原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有2对成对的p电子 | 其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
| A-O | A=O | F-O | F=O | |
| 键能(KJ/mol) | 360 | 803 | 464 | 640 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.

查看答案和解析>>
科目:高中化学 来源: 题型:


 ,判断其中的化学键的类型
,判断其中的化学键的类型查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com