
 (NH4)2S2O8+H2↑,
(NH4)2S2O8+H2↑, 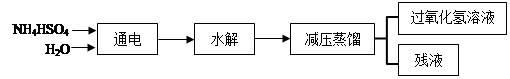
| A.不稳定性 | B.弱碱性 | C.氧化性 | D.还原性 |
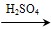 CH3COOOH+H2O(3分)
CH3COOOH+H2O(3分)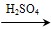 CH3COOOH+H2O
CH3COOOH+H2O

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
 KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )
KMnO4 + H2C2O4 + ( )---K2SO4 + CO2↑+ MnSO4 + ( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③④⑤⑥⑦⑧ | B.②③⑤⑥⑦⑧⑨ |
| C.①②③⑤⑥⑦⑨ | D.①②③④⑤⑥⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
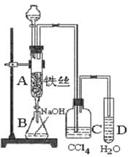
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
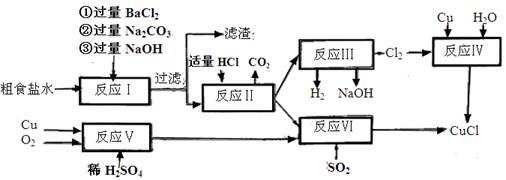
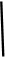 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向氯化铁溶液中不断加入氢氧化钠溶液制备氢氧化铁胶体 |
| B.用铜粉和硫粉混合加热制备硫化铜 |
| C.用铁做阳极电解硫酸钠溶液可以制得氢氧化亚铁 |
| D.向铝盐溶液中不断滴入过量烧碱溶液制备Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
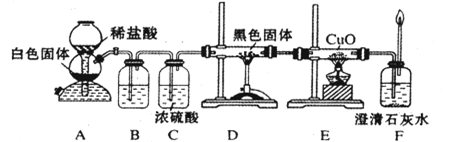
 CO+H2 CO + H2O
CO+H2 CO + H2O CO2 + H2 C + CO2
CO2 + H2 C + CO2 2CO
2CO 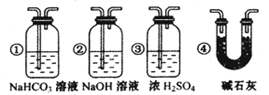
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com