
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是( )
A. ρ=(17V+22 400)/(22.4+22.4V)
B. w=17c/(1 000ρ)
C. w=17V/(17V+22 400)
D. c=1 000Vρ/(17V+22 400)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中,正确的是 ( )
A. 苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B. 从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C. 在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D. 苯分子为平面正六边形结构,6个碳原子之间的键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质)是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬产生的环境污染。铬渣综合利用工艺流程如下:

请回答下列问题:
(1)焙烧得到的产物含有Na2CrO4和一种无污染的气体,则生成Na2CrO4的反应方程式为_____ 。
(2)除去浸出液中的杂质最好加入_____(填试剂名称)来调节pH。除去铝元素的离子方程式为______________。
(3)理论上加入醋酸铅、硝酸铅均可以得到铬酸铅沉淀,工艺流程中不选用醋酸铅的原因是___________。
(4)铬酸铅是一种用于水彩和油彩的筑色颜料.遇到空气中的硫化物颜色会变然,该过积的化学反应方程式为_____________。
(5)实验室常利用Cr3+在碱性溶液中的还原性,使其转化为CrO42-,从而实现与Al3+的分离,这个过程中需要加入的试剂是__________(填化学式),分离操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明溴乙烷中溴元素的存在,下列操作步骤正确的是( )
①加入AgNO3溶液;②加入NaOH水溶液;③加热;④加入蒸馏水⑤加稀硝酸至酸性;⑥加入加入NaOH醇溶液
A. ⑥③⑤① B. ①②③⑤ C. ④⑥③① D. ④③①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
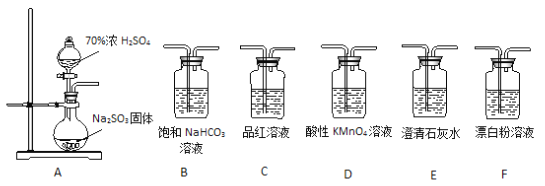
(1)装置A中反应的化学方程式为________________________。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→_________→_________→C→F。
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________,通过______________________现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________。
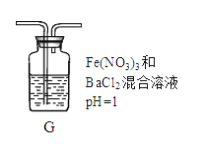
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:__________________。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是________________________。
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是______________,样品中Na2SO3质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H++OH﹣向右移动,且溶液呈酸性的是( )
H++OH﹣向右移动,且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Na2CO3溶液
C. 向水中加入Al2(SO4)3固体 D. 将水加热到100℃,使pH=6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com