

 为该转化过程的催化剂
为该转化过程的催化剂分析 (1)氢气与二氧化碳反应生成甲烷和水蒸气的化学方程式为:CO2(g)+4H2(g)?CH4(g)+2H2O(g),该反应可由已知焓变的热化学方程式推导,根据盖斯定律求解该反应的焓变;
反应①为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.4kJ/mol,随着反应的进行,气体分子数增多,体系压强增大,反应为吸热的反应,因此降低压强,升高温度,均有利于反应向正反应方向进行,据此分析;
(2)①根据图象分析,反应从0~8min内,经历的时间为△t=8min,H2的物质的量变化为△n=8-2=6mol,密闭容器的体积为V=2L,则H2的化学反应平均速率为$\overline{r}$(H2)=$\frac{△n}{V△t}$,根据化学反应的平均速率之比等于化学计量数之比,据此计算CO2的化学平均反应速率;
②仅改变某一条件再进行实验,测得H2物质的量变化如图1虚线所示,根据图象分析,改变条件后,反应更快达到了平衡,表明化学反应速率加快,且平衡向逆反应方向移动,据此判断改变的条件;
(3)①一定量的NO、NO2混合气体通入NaOH溶液恰好反应得NaNO2,据此写出反应的离子方程式,注意配平;
②A室产生了N2,表明NO2-在此反应过程中得到了电子,N元素化合价降低,考虑到NaNO2水解,溶液是碱性,反应中有OH-存在,据此写出电极反应式;
(4)①反应中当有1mol NH3转化为N2H4时,反应失去的电子数为1mol,保持溶液中酮的物质的量不变,根据电子得失守恒计算反应消耗O2的物质的量;
②在温度一定和不补加溶液的条件下,缓慢通入NH3、O2混合气体,并充分搅拌,根据转化图分析, 在反应过程中充当载体的作用,反应前后本身化学性质并不发生改变,整个反应中存在氧化还原反应,据此逐项分析.
在反应过程中充当载体的作用,反应前后本身化学性质并不发生改变,整个反应中存在氧化还原反应,据此逐项分析.
解答 解:(1)氢气与二氧化碳反应生成甲烷和水蒸气的化学方程式为:CO2(g)+4H2(g)?CH4(g)+2H2O(g),该反应可由-(①+②)得到,根据盖斯定律,该反应的焓变为△H=-(△H1+△H2)=-(206.4-41.2)=-165.2kJ/mol,
反应①为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.4kJ/mol,随着反应的进行,气体分子数增多,体系压强增大,反应为吸热的反应,因此降低压强,升高温度,均有利于反应向正反应方向进行,
A.升高温度,使化学平衡向正反应方向移动,能提高平衡体系中H2的百分含量,同时加快反应速率,故A可选;
B.增大水蒸气浓度,使化学平衡正向移动,能提高平衡体系中H2的物质的量,也能提高整体化学反应速率,但增大水蒸气浓度,并不能抵消反应,有可能使平衡体系中H2的百分含量降低,故B不选;
C.加入催化剂,催化剂能加快化学反应速率,但不改变化学平衡,即平衡体系中H2的百分含量和未使用催化剂前一样,故C不选;
D.降低压强,使化学平衡向正反应方向移动,能提高平衡体系中H2的百分含量,但不提高反应的化学反应速率,故D不选,
故答案为:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-165.2kJ/mol;A;
(2)①根据图象分析,反应从0~8min内,经历的时间为△t=8min,H2的物质的量变化为△n=8-2=6mol,密闭容器的体积为V=2L,则H2的化学反应平均速率为$\overline{r}$(H2)=$\frac{△n}{V△t}$=$\frac{6mol}{2L×8min}$=0.375mol/(L•min),根据化学反应的平均速率之比等于化学计量数之比,则$\overline{r}(C{O}_{2})$=$\frac{1}{3}\overline{r}({H}_{2})$=0.125mol/(L•min),
故答案为:0.125mol/(L•min);
②仅改变某一条件再进行实验,测得H2物质的量变化如图1虚线所示,根据图象分析,改变条件后,反应更快达到了平衡,表明化学反应速率加快,且平衡向逆反应方向移动,因此曲线I改变的条件可能是升温,
故答案为:升温;
(3)①一定量的NO、NO2混合气体通入NaOH溶液恰好反应得NaNO2,则反应的离子方程式为:NO+NO2+2OH-═2NO2-+H2O,
故答案为:NO+NO2+2OH-═2NO2-+H2O;
②A室产生了N2,表明NO2-在此反应过程中得到了电子,N元素化合价降低,考虑到NaNO2水解,溶液是碱性,反应中有OH-存在,由于反应是得到电子的反应,根据电荷守恒,反应应该是生成OH-,因此A室中NO2-发生反应的电极反应式是:2NO2-+6e-+6H2O═8OH-+N2↑,
故答案为:2NO2-+6e-+6H2O═8OH-+N2↑;
(4)①反应中当有1mol NH3转化为N2H4时,N从-3价变为-2价,则1molNH3反应失去的电子数为1mol,保持溶液中酮的物质的量不变,1molO2参加反应失去的电子数为2×2=4mol,根据电子得失守恒,需要消耗O2的物质的量为n(O2)=$\frac{1}{4}$=0.25mol,
故答案为:0.25mol;
②在温度一定和不补加溶液的条件下,缓慢通入NH3、O2混合气体,并充分搅拌,根据转化图分析, 在反应过程中充当载体的作用,反应前后本身化学性质并不发生改变,整个反应中存在氧化还原反应,
在反应过程中充当载体的作用,反应前后本身化学性质并不发生改变,整个反应中存在氧化还原反应,
A. 在反应过程中充当载体的作用,反应前后本身化学性质并不发生改变,充当催化剂的作用,故A正确;
在反应过程中充当载体的作用,反应前后本身化学性质并不发生改变,充当催化剂的作用,故A正确;
B.欲使生成的N2H4中不含NH3,可考虑将NH3催化氧化成N2H4,可适当增大通入的空气量达到目的,故B正确;
C.上述转化过程中通入空气,空气中的O2为氧化剂,反应存在氧化还原反应,故C错误;
故选AB.
点评 本题主要考察化学原理部分知识,包含热化学方程式的书写,盖斯定律的应用,化学平衡的移动,化学反应速率对的计算,氧化还原反应方程式的书写和配平及计算,流程的分析,牢牢把握守恒思想是关键.本题涉及的知识点较多,是综合题,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| B. | 乙酸与乙醇可发生酯化反应,均可与金属钠发生置换反应 | |
| C. | 分馏、干馏都是物理变化,裂化、裂解都是化学变化 | |
| D. | 石油经过分馏得到多种烃,煤经过分馏可制焦炭、煤焦油等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题:
CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题: (用箭头表示出配位键的位置)
(用箭头表示出配位键的位置)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:
硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| B. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| C. | 0.1 mol•L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,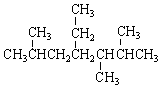 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 肌醇 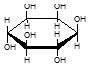 与葡萄糖 与葡萄糖 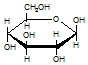 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的 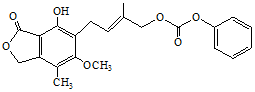 最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 外加电流的阴极保护法中,X是待保护金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化都是物理变化 | |
| B. | 煤的干馏和石油的分馏发生的都是化学变化 | |
| C. | 用溴的四氯化碳溶液可鉴别 直馏汽油和裂化汽油 | |
| D. | 煤和石油都是混合物,都只由碳和氢两种元素组成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com