
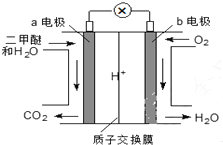
 二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚(CH3OCH3)是一种绿色、可再生的新能源.右图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔Pt电极).该电池工作时,下列说法不正确的是( )| A. | a电极为该电池负极 | |
| B. | O2在b电极上反应为O2+2H2O+4e-=4OH- | |
| C. | 电池工作时,若a电极上有1molCH3OCH3放电,电路中有12mol电子转移 | |
| D. | 电池工作时,电池内部H+从a电极移向b电极 |
分析 氧气得电子,化合价降低,故b电极是正极,电极反应式:O2+4e-+4H+═2H2O;由图知在a电极二甲醚与水反应生成二氧化碳和氢离子,故a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+,据此分析解答.
解答 解:A.通燃料的a极,失电子,为负极,故A正确;
B.O2在b电极上得电子,被还原,电极反应式:O2+4e-+4H+═2H2O,酸性条件下不可能产生氢氧根离子,故B错误;
C.在a电极二甲醚与水反应生成二氧化碳和氢离子,故a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+,所以a电极上有1molCH3OCH3放电,电路中有12mol电子转移,故C正确;
D.a极为负极,二甲醚放电生成二氧化碳,由离子交换膜可知还生成氢离子,H+从a负极移向b正极,故D正确.
故选B.
点评 本题考查原电池工作原理,题目难度不大,会书写电极反应式是解题的关键.


科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
将1 mol CH4和适量的O2在密闭容器中点燃,充分反应后,CH4和O2均无剩余,且产物均为气体(101 kPa、120℃),总质量为72 g,下列有关叙述不正确的是( )
A.若将产物通过碱石灰,则不能被完全吸收
B.产物的平均摩尔质量为24 g•mol-1
C.若将产物通过浓硫酸,充分吸收后,浓硫酸增重18 g
D.反应中消耗56 g O2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质一定易溶于水 | |
| B. | 常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸的水的电离程度小 | |
| C. | 对可逆反应,升高温度一定存在v(正)>v(逆) | |
| D. | 钢铁在海水中发生电化腐蚀时,铁是正极被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C |  的一氯代物 的一氯代物 | 有5种 |
| D | 蛋白质水解的最终产物 | 多肽 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | 燃烧热/kJ•mol-1 | 化合物 | 燃烧热/kJ•mol-1 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 异戊烷 | 3531.3 |
| A. | 正戊烷的燃烧热小于3531.3kJ•mol-1 | |
| B. | 稳定性:正丁烷>异丁烷 | |
| C. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g);△H=-1560.8 kJ | |
| D. | 相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
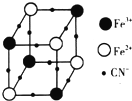 过渡金属元素及其化合物在合金材料以及催化剂等方面应用非常广泛.
过渡金属元素及其化合物在合金材料以及催化剂等方面应用非常广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com