
分析 令氨气为700L,则水为1L,根据n=$\frac{V}{{V}_{m}}$计算氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据V=$\frac{m}{ρ}$计算溶液的体积,再根据c=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:令氨气为700L,则水为1L,
氨气的物质的量=$\frac{700L}{22.4L/mol}$=$\frac{700}{22.4}$mol,氨气的质量=$\frac{700}{22.4}$mol×17g/mol=$\frac{17×700}{22.4}$g,
水的质量=1L×1000g/L=1000g,
溶液的体积=$\frac{\frac{17×700}{22.4}g+1000g}{892g/L}$=$\frac{22400+17×700}{22.4×892}$L,
所得氨水的物质的量浓度=$\frac{\frac{700}{22.4}mol}{\frac{22400+17×700}{22.4×892}L}$=18.27mol/L,
答:此氨水溶液的物质的量浓度为18.27mol/L.
点评 本题考查物质的量浓度计算,难度不大,侧重对物质的量浓度定义考查.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl不导电,因此HCl是非电解质 | |
| B. | Na2O熔融态时能导电,所以Na2O是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | CO2水溶液能导电,所以CO2是电解质. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe→Fe2O3→Fe(OH)3 | B. | SO2→SO3→H2SO4 | ||
| C. | FeCl2→Fe(OH)2→Fe(OH)3 | D. | NO→NO2→HON3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 放电时,锂为负极,发生还原反应 | |
| B. | 充电时阳极反应式为:8Li2S-16e-═S8+16Li+ | |
| C. | 电解质可采用导电有机电解质 | |
| D. | 锂硫电池的理论电压为2.0V,则单位质量的单质硫的比能量为3.35 kW•h/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol | B. | 1.33 mol | C. | 2 mol | D. | 3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
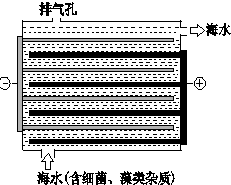 海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.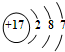 ,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).
,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com