
【题目】石油是工业的血液,通过它可以得到很多重要的化工产品。

已知: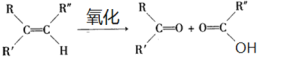
(1)B和A为同系物,B的结构简式为_________________;
(2)反应①的化学方程式为__________________,其反应类型为___________;
(3)写出检验C3H5Cl中含有Cl原子的方法:______________;
(4)C的结构简式为______________;
(5)反应④的化学方程式为_______________;
(6)设计一条由乙烯为原料制备D的合成路线(其他无机原料任选)____________。(合成路线格式如下:CH3CH2OH ![]() H2C=CH2
H2C=CH2 ![]() BrCH2CH2Br)
BrCH2CH2Br)
【答案】CH2=CHCH3 CH2=CH2+H2O![]() CH3CH2OH 加成反应 加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl原子 HOOC—COOH CH2=CHCH2Cl+NaOH
CH3CH2OH 加成反应 加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl原子 HOOC—COOH CH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaCl
CH2=CHCH2OH+NaCl 
【解析】
C2H6O与C反应生成D,由D的结构简式可知C为HOOC-COOH,C2H6O为CH3CH2OH,则A为CH2=CH2,与水发生加成反应生成乙醇;C3H5Cl发生卤代烃的水解反应生成CH2=CHCH2OH,则C3H5Cl为CH2=CHCH2Cl,B为CH2=CHCH3,据此分析解答。
(1)由于B与氯气反应产物为C3H5Cl,该反应为取代反应,故B分子式为C3H6,B和A为同系物,可知B中含有一个不饱和键,根据分子式可推知B为CH2=CHCH3,故答案为:CH2=CHCH3;
(2)由以上分析可知,A为CH2=CH2,反应①的化学方程式为CH2=CH2+H2O![]() CH3CH2OH,为加成反应,故答案为:CH2=CH2+H2O
CH3CH2OH,为加成反应,故答案为:CH2=CH2+H2O![]() CH3CH2OH;加成反应;
CH3CH2OH;加成反应;
(3)检验C3H5Cl中含有Cl原子的方法为:加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl原子;故答案为:加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl原子;
(4)根据以上分析可知,C为HOOC-COOH,故答案为:HOOC-COOH;
(5)反应④为卤代烃的水解反应,反应的化学方程式为CH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaCl,故答案为:CH2=CHCH2Cl+NaOH
CH2=CHCH2OH+NaCl,故答案为:CH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaCl;
CH2=CHCH2OH+NaCl;
(6)D为乙二酸二乙酯,则由乙二酸和乙醇发生酯化反应制得,乙烯与水发生加成反应可生成乙醇,乙烯与溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷在氢氧化钠的水溶液中水解生成乙二醇,乙二醇氧化可以生成乙二酸,所以由乙烯为原料制备D的合成路线为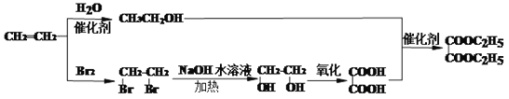 ,故答案为:
,故答案为: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”的锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是
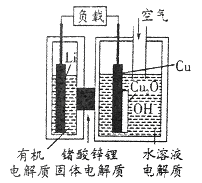
A. 正极为Li,负极为Cu
B. 放电时,正极的电极反应为:2Cu+2OH-+2e-==Cu2O+2H2O
C. Li极有机电解质可以换成Cu极的水溶液电解质
D. 通空气时,整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | a | b | c |
工业上合成氨的反应 N2(g)+3H2(g) 2NH3(g) ΔH=_____kJ·mol-1.
(2)肼—空气燃料电池是一种环保型燃料电池,结构如图 1 所示
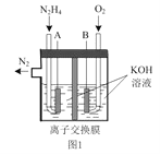
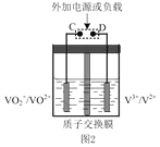
①肼—空气燃料电池的负极反应式为_____
②全钒液流可充电电池结构如图 2 所示,将肼—空气燃料电池的 A 极与全钒液流可充电电池的 C 极相连,B 极与 D 极相连,写出阴极的电极反应____
(3)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,与使用 Na2SO3 处理水中溶解的 O2 相比,肼的优点是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石与石墨是同素异形体。100 kPa时,1 mol石墨转化为金刚石的能量变化如图所示,下列说法正确的是

A.石墨转化为金刚石的反应为放热反应
B.石墨比金刚石更稳定
C.金刚石比石墨更稳定
D.破坏1 mol石墨的化学键所吸收的能量小于形成1 mol金刚石的化学键所放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,测得C的浓度为0.2mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,测得C的浓度为0.2mol·L-1。下列判断错误的是( )
A.x=1
B.B的转化率为40%
C.2min内A的反应速率为0.6mol·L-1·min-1
D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下离子中的若干种:NH4+、Ba2+、Fe2+、Cl-、NO3-、CO32- 、SO42-.某同学收集了该地区的雾霾,经必要的预处理后得到试样溶液,设计并完成如下实验:

试回答下列问题:
(1)实验①中加入稀盐酸后,有无色气体A生成,溶液B依然澄清,且溶液中阴离子种类不变,据此可知原溶液中一定不含__________。(填离子符号)
(2)实验①中发生反应的离子方程式为__________________________________________。
(3)实验②中逐滴加入碳酸氢钠溶液,立即有气泡产生,一段时间后又有沉淀出现,这时的离子方程式为_______________________________________________ 。
(4)气体F的成分为______________。(填化学式)
(5)根据实验③现象该同学认为原溶液中一定含有SO42-,有其他同学认为其结论不合理,又进行了后续实验 ④,最终确认原溶液中含有SO42-,试写出实验④可行的操作方法及现象________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.配制0.5 L 10 mol·L-1的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g· cm-3)与10 mL 18.4 mol·L-1硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四物质有如下转化关系(反应条件和部分产物已略去):A![]() B
B![]() C
C![]() D。回答下列问题:
D。回答下列问题:
(1)若A为气态氢化物和D能通过化合反应生成一种盐,则:
①简述检验A气体的方法_________________________________________;
②写出D制备B的离子方程式_________________________________________;
③写出由A生成B的化学方程式_________________________________________;
④某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因______________________________;
(2)若A与B反应能生成一种淡黄色固体单质。写出B→C的化学方程式_____________;
(3)若A是金属单质,C是一种淡黄色固体。写出C的电子式________说出C的一种用途_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com