
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
分析 (1)用Na2S2O3固体来配制标准溶液,不需要圆底烧瓶、分液漏斗;溶解Na2S2O3固体,还需要烧杯、玻璃棒;
(2)实验室没有450mL的容量瓶,应选用500mL的容量瓶,需要Na2S2O3固体,n=0.2000mol/L×0.5L=1.000mol,m=1.000mol×158g/mol=15.8g;定容时,还需要向容量瓶中加入蒸馏水,若容量瓶用蒸馏水洗涤后未干燥,不会产生误差;未等溶液冷却就定容了,冷却后,溶液体积减小,所得溶液浓度偏大;
(3)①NaClO溶液中加入适量稀盐酸和足量KI固体时发生氧化还原反应,其离子方程式为ClO-+2I-+2H+═Cl-+I2+H2O;
②先求四次平行实验测定的平均V(Na2S2O3),
设NaClO溶液的浓度是x.由ClO-+2I-+2H+═Cl-+I2+H2O、I2+2Na2S2O3═2NaI+Na2S4O6
找到关系式:NaClO~2Na2S4O6
1 2
20mL×c 0.2000mol/L×21.20mL
解之得:c=0.1060mol/L.
解答 解:(1)用Na2S2O3固体来配制标准溶液,不需要圆底烧瓶、分液漏斗;溶解Na2S2O3固体,还需要烧杯、玻璃棒;
故答案为:AB;烧杯、玻璃棒;
(2)配制0.2000mol•L -1Na2S2O3标准溶液450mL,实验室没有450mL的容量瓶,应选用500mL的容量瓶,需要Na2S2O3固体,n=0.2000mol/L×0.5L=1.000mol,m=1.000mol×158g/mol=15.8g;定容时,还需要向容量瓶中加入蒸馏水,若容量瓶用蒸馏水洗涤后未干燥,不会产生误差;未等溶液冷却就定容了,冷却后,溶液体积减小,所得溶液浓度偏大;
故答案为:15.8;=;>;
(3)①NaClO溶液中加入适量稀盐酸和足量KI固体时发生氧化还原反应,其离子方程式为ClO-+2I-+2H+═Cl-+I2+H2O;
故答案为:ClO-+2I-+2H+═Cl-+I2+H2O;
②四次平行实验测定的平均体积为:V(Na2S2O3)=$\frac{21.90mL+18.80mL+22.10mL+22.00mL}{4}$=21.20mL,
设NaClO溶液的浓度是x,根据反应ClO-+2I-+2H+═Cl-+I2+H2O、I2+2Na2S2O3═2NaI+Na2S4O6
可得关系式:NaClO~2Na2S4O6
1 2
20mL×c 0.2000mol/L×21.20mL
解得:c=0.1060mol/L,
故答案为:0.1060 mol/L.
点评 本题考查溶液的配制、误差分析、关系式计算等知识,题目难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.


科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
下列关于电解质的叙述中,正确的是
①硫酸银在水中的溶解度很小,其溶液的导电能力很弱,所以硫酸银是弱电解质
②碳酸钙在水中的溶解度虽小,但溶解的部分全部电离,所以碳酸钙是强电解质
③氨气的水溶液导电性很好,所以它是强电解质
④水难电离,纯水几乎不导电,所以水是弱电解质
A.② B.① C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定
Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 610 | 413 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
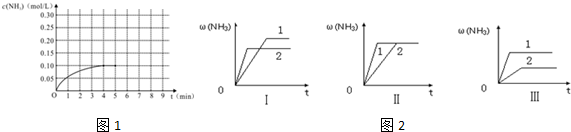
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 残留的固体 | 排放的气体 | |
| A | Na2CO3 | O2、CO2和H2O(g) |
| B | K2CO3 、Na2CO3 | O2和H2O(g) |
| C | NaOH、K2CO3 | O2和CO2 |
| D | Na2O2、NaOH、Na2CO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (O2)=0.0125 mol•(L•s)-1 | B. | v (NO)=0.01mol•(L•s)-1 | ||
| C. | v (H2O)=0.12 mol•(L•s)-1 | D. | v(NH3)=0.1 mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
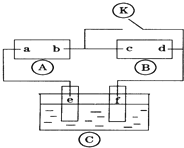 图中
图中 为直流电,
为直流电, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀池.接通电路后发现
为电镀池.接通电路后发现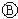 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通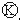 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | b为直流电的正极 | B. | e电极为铁 | ||
| C. | f极发生还原反应 | D. | d极发生的反应为:2H++2e-=H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com