
|
已知相同温度时,同浓度的HCO 的电离程度大于HS-的电离程度.将0.1mol·L-1的盐酸缓慢滴入0.1mol·L-1的Na2S溶液中,当等体积混合后,溶液中下列粒子浓度的大小关系正确的是 | |
| [ ] | |
A. |
c(Cl?/SUP>)>c(HS?/SUP>)>c(H+)>c(OH?/SUP>) |
B. |
c(Cl?/SUP>)>c(H2S)>c(HS?/SUP>)>c(OH?/SUP>) |
C. |
c(Cl?/SUP>)>c(HS?/SUP>)>c(H2S)>c(S2?/SUP>) |
D. |
c(Cl?/SUP>)>c(S2?/SUP>)>c(HS?/SUP>)>c(H+) |
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
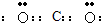
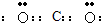
| 压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 3 |
| 2 |
| 1 |
| 3 |
| 2 |
| 3 |
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省石家庄市高三补充题、压轴题化学试卷(解析版) 题型:填空题
.(13分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+
 O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
反应:Fe2O3(s)+
3CO(g) 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ.反应 1/3Fe2O3(s)+
CO(g) 2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
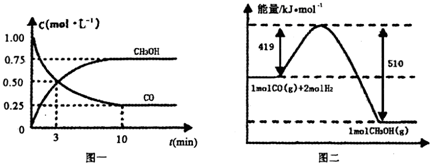
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+
2H2(g) CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
|
容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
|
甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1 kJ热量 |
|
乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2 kJ热量 |
|
丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3 kJ热量 |
则下列关系正确的是________.
A c1=c2 B.2Q1=Q3 C. 2α1=α2 D. α1+α2=1
E. 该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l mol CO、2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式___ ____。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省吉安市高三最后一次模拟考试(理综)化学部分 题型:填空题
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:

回答下列问题:(各元素用相应的元素符号表示)
⑴写出X和Y形成的化合物的电子式 。
⑵阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反
应的化学方程式
⑶写出反应②的化学方程式为 。
⑷某温度下在容积固定的密闭容器中,下列反应达到平衡:
M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M转化率 |
H2O转化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=
—44kJ/mol,写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、
2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
查看答案和解析>>
科目:高中化学 来源:2010-2011学年东北师大附中、哈师大附中,辽宁实验中学三校高三第二次联合模拟考试(理综 题型:填空题
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:
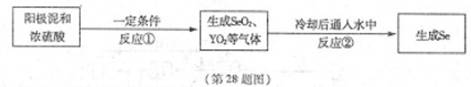
回答下列问题:(各元素用相应的元素符号表示)
(1)写出X和Y形成的化合物的电子式 。
(2)阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反应的化学方程式 。
(3)写出反应②的化学方程式为 。
(4)某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)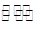 N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M转化率 |
H2O转化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=—44kJ/mol,
写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com