
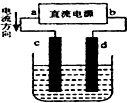
| A. | c、d电极上都有气体产生 | B. | d为阴极、c为阳极 | ||
| C. | d极附近溶液PH值升高 | D. | 电解过程中,氯离子浓度减小 |
分析 在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极,阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气,据此分析.
解答 解:在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极.
A、阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气,故A正确;
B、由分析可知,d为阴极、c为阳极,故B正确;
C、d极上氢离子得电子生成氢气和氢氧根离子,氢氧根离子结合镁离子生成氢氧化镁沉淀,所以溶液的pH不会升高,故C错误;
D、电解过程中,氯离子在阳极上失电子产生氯气,氯离子浓度减小,故D正确.
故选C.
点评 本题考查电解池的工作原理,题目难度不大,会根据电子流向和电流流向判断电源的正负极,从而确定电极的阴阳极,侧重于考查学生的分析能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E为原子序数依次增大的五种短周期元素,A、B、C位于同一周期,C、E位于同一主族,A元素在自然界中形成的化合物种类最多,C元素的氢化物是最常用的溶剂,D元素在同周期元素中离子半径最小.请回答:
A、B、C、D、E为原子序数依次增大的五种短周期元素,A、B、C位于同一周期,C、E位于同一主族,A元素在自然界中形成的化合物种类最多,C元素的氢化物是最常用的溶剂,D元素在同周期元素中离子半径最小.请回答: ;D元素的最高价氧化物的水化物的电离方程式Al(OH)3?Al3++3OH-.
;D元素的最高价氧化物的水化物的电离方程式Al(OH)3?Al3++3OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三个烧杯中一定均会发生的离子反应有:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 三个烧杯中钠均在液面上剧烈反应 | |
| C. | Z烧杯中一定会有沉淀生成,但沉淀不是单质铜 | |
| D. | 三个烧杯中生成氢气的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
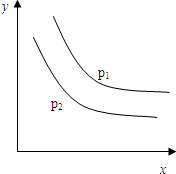
| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a+b>c | D. | a+b<c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
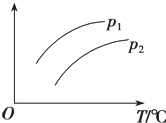 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g)△H>0;平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g)△H>0;平衡移动关系如图所示.下列说法正确的是( )| A. | p1<p2,纵坐标指A的体积分数 | |
| B. | p1>p2,纵坐标指C的质量分数 | |
| C. | p1<p2,纵坐标指A的转化率 | |
| D. | p1<p2,纵坐标指混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先滴加BaCl2溶液再滴加HCl溶液,生成白色沉淀,原溶液中有SO42- | |
| B. | 滴加氯水和CCl4,振荡、静置,上层溶液显紫色,原溶液中有I- | |
| C. | 用洁净铁丝蘸取溶液进行焰色反应,火焰呈黄色,原溶液中有Na+ | |
| D. | 滴加NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com