
分析 (1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,据此解答;
(2)依据配制步骤选择需要仪器;依据配制溶液体积选择容量瓶规格;容量瓶带有活塞,为防止使用过程中漏水,使用前需要检查是否漏水;
(3)依据m=CVM计算需要溶质的质量;称量腐蚀物质应在小烧杯中进行;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(5)依据溶液稀释过程中所含溶质的物质的量不变计算.
解答 解:(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,
故答案为:溶解;移液;洗涤;
(2)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、容量瓶,配制1.0mol•L-1的NaOH溶液230mL,应选择250mL容量瓶,所以还缺少仪器:250mL容量瓶;容量瓶带有活塞,为防止使用过程中漏水,使用前需要检查是否漏水;
故答案为:250mL容量瓶;查漏;
(3)配制1.0mol•L-1的NaOH溶液230mL,应选择250mL容量瓶,需要溶质的质量m=1.0mol/L×0.25L×40g/mol=10.0g;氢氧化钠具有腐蚀性,应在烧杯中称量;
故答案为:10.0;烧杯;
(4)A.没有洗涤烧杯和玻璃棒,导致溶质物质的量偏小,溶液浓度偏小,故不选;
B.转移溶液时不慎有少量洒到容量瓶外面,导致溶质物质的量偏小,溶液浓度偏小,故不选;
C.容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故不选;
D.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故D选;
E.未冷却到室温就将溶液转移到容量瓶并定容,冷却后溶液体积偏小,溶液浓度偏高,故E选;
故答案为:DE;
(5)设稀释后溶液浓度为:C,则依据溶液稀释过程中所含溶质的物质的量不变得:1.0mol•L-1×100mL=1000mL×C,解得C=0.1mol/L;
故答案为:0.1mol/L.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.


科目:高中化学 来源: 题型:解答题
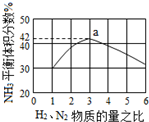 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
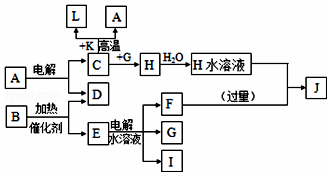 已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图: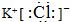
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2(NaOH) | B. | SnCl2(HCl) | C. | FeCl3(HCl) | D. | FeSO4(Fe) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①中铁钉做氧化剂 | |
| B. | 实验②中Fe2+具有还原性 | |
| C. | 实验③中发生的是置换反应 | |
| D. | 上述实验证明氧化性Fe3+>Fe2+>Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和NaHCO3粉末与同浓度盐酸反应,Na2CO3碱性强,反应放出气体速度快 | |
| B. | 等物质的量的两种盐与同浓度的盐酸反应,Na2CO3消耗盐酸的体积是NaHCO3的两倍 | |
| C. | 向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出 | |
| D. | Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4LCO2所含的原子数为3NA | |
| B. | 1molCl2与足量的Fe完全反应,转移的电子数为2NA | |
| C. | 0.5molC2H2和C6H6的气态混合物中所含原子总数为2NA | |
| D. | 2L1mol/L的盐酸中所含HCl分子数约为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的盐酸和0.1mol/L的氨水等体积混合 | |
| B. | pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 | |
| C. | pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com