
| A. | ③④ | B. | ③ | C. | ①③ | D. | ②④ |
分析 氯化银悬浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),即沉淀电离为离子的速率与离子结合成沉淀的速率相等,该过程为可逆过程,据此进行解答.
解答 解:①AgCl(s)?Ag+(aq)+Cl-(aq)为AgCl的沉淀溶解平衡,不是电离方程式,AgCl在熔融状态下完全电离,为强电解质,故①错误;
②该反应为AgCl的沉淀溶解平衡,不是电离方程式,根据该平衡不能判断AgCl为强电解质,故②错误;
③AgCl(s)?Ag+(aq)+Cl-(aq)为可逆反应,说明Cl-与Ag+的反应不能完全进行到底,故③正确;
④AgCl(s)?Ag+(aq)+Cl-(aq)为可逆过程,所以Ag+与Cl-的反应不能完全进行到底,故④错误;
故选B.
点评 本题考查了沉淀溶解平衡的应用,题目难度不大,注意对沉淀溶解平衡方程式的理解,明确难溶物溶解平衡及其沉淀转化的本质为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
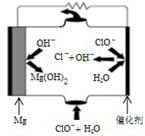 利用所学知识回答下列问题
利用所学知识回答下列问题| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 1.0×10-7 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H<0 | |
| B. | 用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl溶解度大于Ag2CrO4溶解度 | |
| D. | 25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
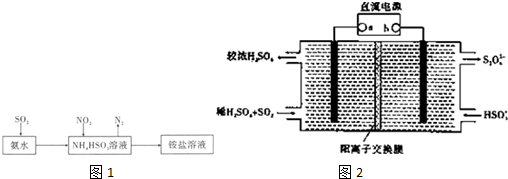
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积 | |
| B. | 溶度积常数是不受任何条件影响的常数,简称溶度积 | |
| C. | 可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向 | |
| D. | 所有物质的溶度积都是随温度的升高而增大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com