
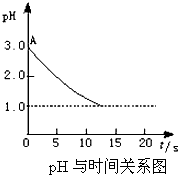
 某课题小组的同学对“电解氯化铜溶液时的pH变化”的问题,有以下两种不同的观点:
某课题小组的同学对“电解氯化铜溶液时的pH变化”的问题,有以下两种不同的观点:分析 (1)实验室中,简易测定溶液pH的操作方法:将一小片pH 试纸放在玻璃片或表面皿上,用干净玻璃棒蘸取待测溶液,点在pH 试纸中央,待试纸变色后与标准比色卡对比;
(2)根据水解平衡的移动判断氢离子的浓度变化,从而判断PH值变化;
(3)根据电解生成物的性质判断溶液的酸碱性.
解答 解:(1)实验室中,简易测定溶液pH的操作方法:将一小片pH 试纸放在玻璃片或表面皿上,用干净玻璃棒蘸取待测溶液,点在pH 试纸中央,待试纸变色后与标准比色卡对比,故答案为:将一小片pH 试纸放在玻璃片或表面皿上,用干净玻璃棒蘸取待测溶液,点在pH 试纸中央,待试纸变色后与标准比色卡对比;
(2)电解过程中铜不断析出,铜离子浓度逐渐降低,使反应Cu2++2H2O?Cu(OH)2+2H+向逆反应方向进行,氢离子浓度降低,pH上升.
故答案为:因为Cu2++2e-═Cu,使Cu2+水解平衡向左移动,c(H+)减少,pH上升;
(3)电解氯化铜生成氯气和铜,氯气易溶于水,生成盐酸和次氯酸,使溶液酸性增强,所以PH降低.
故答案为:CuCl2═Cu+Cl2↑,Cl2+H2O═HCl+HClO,使溶液酸性增强,pH降低.
点评 本题考查电解原理,为高频考点,明确理论与实际的区别是解本题关键,知道电解过程中离子放电顺序,题目难度不大.


科目:高中化学 来源: 题型:推断题
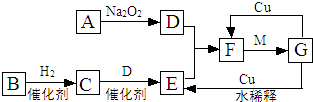
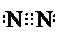 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解食盐水若产生2g氢气,则转移的电子数目为NA | |
| B. | 电解精炼铜时转移0.1 NA个电子,则阳极溶解3.2g铜 | |
| C. | VL amol/L FeCl3 溶液中,若Fe3+数目为NA,则Cl-的数目大于3NA | |
| D. | 100mL 1mol/L的醋酸溶液中,CH3COO-离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
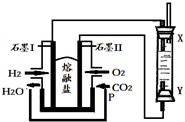
| A. | X、Y两端都必须用铁作电极 | B. | 不可以用NaOH溶液作为电解液 | ||
| C. | 阴极发生的反应是:2H++2e-=H2↑ | D. | 白色沉淀只能在阳极上产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H++2e-═H2↑ | B. | Fe-2e-═Fe2+ | ||
| C. | 4OH--4e-═2H2O+O2↑ | D. | Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H12O6$\stackrel{酒化酶}{→}$2C2H6O+2CO2↑ | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | HC≡CH+HCl$\stackrel{一定条件}{→}$CH2=CHCl | D. | 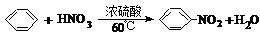 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com