
【题目】(1)氢键作用常表示为“A—H…B”,其中A、B为电负性很强的一类原子,用氢键的表示方法写出HF溶液中存在的所有氢键________________________。
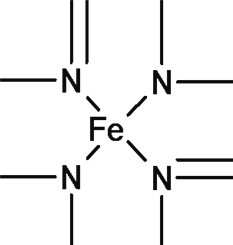
(2)已知某配合物中有如下结构,则N原子的杂化方式为___________,在结构式上用“→”标出配位键。___________
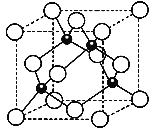
(3)Al和N组成的晶胞结构如下图一所示(“O”表示Al原子):
①则其化学式为_____,Al原子的配位数是___;
②一个N原子周围距离最近且等距的N原子有_____个。
【答案】 F-H…F F-H…O O-H…F O-H…O sp3 sp2 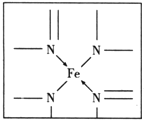 AlN 4 12个
AlN 4 12个
【解析】(1)氢键作用常表示为“A—H…B”,其中A、B为电负性很强的一类原子,用氢键的表示方法写出HF溶液中存在的所有氢键:F-H…F、F-H…O 、O-H…F、O-H…O;(2)根据结构图可看出N原子既有单键还有双键,所以既有sp2杂化,还有sp3杂化。N原子最外层有孤对电子,而亚铁离子有容纳电子的空轨道,所以可形成配位键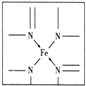 ;(3)①由晶胞结构可知,晶胞中N离子处于晶胞内部,晶胞中含有4个N离子,Al离子处于顶点与面心,晶胞中Al离子数目为8×
;(3)①由晶胞结构可知,晶胞中N离子处于晶胞内部,晶胞中含有4个N离子,Al离子处于顶点与面心,晶胞中Al离子数目为8×![]() +6×
+6×![]() =4,故该化合物化学式为AlN,AlN晶体与金刚石类似,每个Al离子与4个N离子相连,为空间网状结构,与同一个Al离子相连的N原子构成正四面体,Al离子的配位数是4;②一个Al离子周围距离最近的Al离子个数=3×8×
=4,故该化合物化学式为AlN,AlN晶体与金刚石类似,每个Al离子与4个N离子相连,为空间网状结构,与同一个Al离子相连的N原子构成正四面体,Al离子的配位数是4;②一个Al离子周围距离最近的Al离子个数=3×8×![]() =12。
=12。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关天然产物水解叙述不正确的是
A、油脂水解可得丙三醇
B.可用碘检验淀粉是否水解完全
C、蛋白质水解的最终产物均为氨基酸
D.纤维素水解和淀粉水解得到的最终产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的。
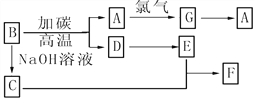
(1)试推测A________、C__________、F__________(写化学式)。
(2)试写出以下的化学方程式,是离子反应的写出离子方程式:
B→A______________;C+E→F______________
(3)在B+碳→A+D的反应中,碳的作用是________,当生成1 mol A时,转移电子的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气中常含有H2S 等有毒气体,下面是以天然气为原料合成氨的工艺流程图。(反应条件已略去)
请根据图回答下列问题。
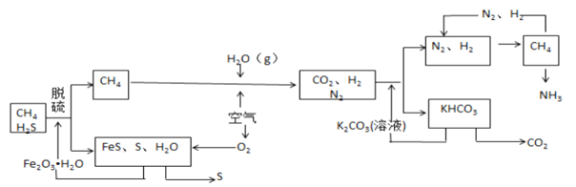
(1)将天然气直接燃烧,产生的有害物质是______________,,引起的环境问题是___________________。
(2)从空气中分离出O2 的方法是______________。
(3)一定条件下发生脱硫反应的化学方程式是_______________________。
(4)上图流程中K2CO3溶液的作用是________________,该反应的离子方程式是_____________。
(5)工业合成氨的化学方程式是_____________,生成的氨气可用于____________(写一条)。
(6)该工艺流程中有多处循环,参与循环的物质有N2、H2、___________和_____________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一价离子组成四种盐,AC、BD、AD、BC的1mol·L-1 溶液,在室温下前两种溶液的pH=7,第三种溶液的pH >7,最后一种溶液的pH< 7,则。
A | B | C | D | |
碱性 | AOH>BOH | AOH<BOH | AOH>BOH | AOH<BOH |
酸性 | HC>HD | HC>HD | HC<HD | HC<HD |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有广泛用途。
(1)铝元素位于元素周期表中第_______周期、第________族。
(2)19Al 是铝的一种核素,其中子数是_______。
(3)铝热反应可用于焊接钢轨,下图为铝热反应的实验装置图。
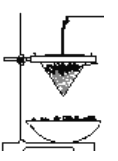
①该铝热反应的化学方程式是_______,该反应的现象是_______,此现象说明反应物的总能量_______生成物的总能量( 填“﹤ ” “﹥ ”“=”)。
②反应结束后,从沙中取出生成的固体物质,有同学推测该固体是铁铝合金,他设计了如下实验证明此固体中含有金属铝:取少量固体于试管中,滴加_______,当观察到_______现象时, 证明固体中含有金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是利用微生物燃料电池处理工业含酚废水的原理示意图,下列说法不正确的是
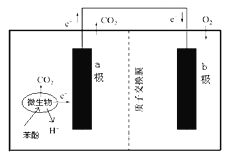
A.该装置可将化学能转化为电能
B.溶液中H+由a极移向b极
C.电极b 附近的pH降低
D.电极a附近发生的反应是C6H6O-28e- + 11H2O![]() 6CO2 + 28H+
6CO2 + 28H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种主要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组就此粉末为原料回收铈,设计实验流程如下:
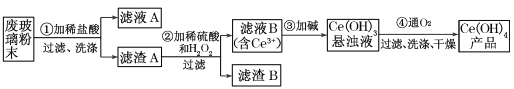
(1)洗涤滤渣A的目的是为了除去_____________(填离子符号),检验该离子是否洗净的方法是________________。
(2)第②步反应的离子方程式是___________________,滤渣B的主要成分是___________。
(3)萃取是分离稀士元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP_______(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有___________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000 mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准维液,该产品中Ce(OH)4的质量分数为_______________(保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com