
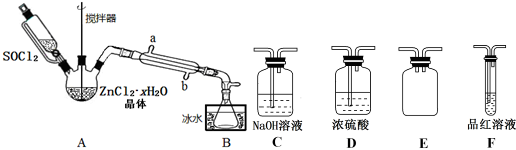
分析 (1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则反应的方程式为2S+3Cl2+SO3$\frac{\underline{\;一定条件\;}}{\;}$3SOCl2,根据方程式可知三者的物质的量比,SOCl2遇水剧烈反应生成SO2与HCl;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气种二氧化硫与HCl,防止污染环境,E装置防止倒吸;
②搅拌可以增大接触面积,加快反应速率;根据逆流冷却效果好进行判断;
③ZnCl2•xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,结合氯离子守恒计算;
④ZnCl2加热时会水解为氢氧化锌与HCl,氯化氢挥发,氢氧化锌受热分解为ZnO;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,可以检验硫酸根、亚铁离子或铁离子判断;
解答 解:(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则反应的方程式为2S+3Cl2+SO3$\frac{\underline{\;一定条件\;}}{\;}$3SOCl2,所以三者的物质的量比为2:3:1,SOCl2遇水剧烈反应生成SO2与HCl,反应方程式为:SOCl2+H2O=SO2↑+2HCl↑,
故答案为:2:3:1;SOCl2+H2O=SO2↑+2HCl↑;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气中二氧化硫与HCl,防止污染环境,E装置防止倒吸,装置的连接顺序为A→B→D→E→F→C,
故答案为:D,E,F,C;
②搅拌可以增大接触面积,加快脱水速率;逆流冷却效果好,应从b口进水,
故答案为:b;
③ZnCl2•xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,由氯离子守恒:$\frac{ag}{136g/mol}$×2=$\frac{bg}{143.5g/mol}$,整理可得$\frac{b}{a}$=2.1,
故答案为:2.1;
④ZnCl2加热时会水解为氢氧化锌与HCl,氯化氢挥发,氢氧化锌受热分解为ZnO,不能得到ZnCl2,该方案不可行,反应的方程式为ZnCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+ZnO+(x-1)H2O,
故答案为:不可行,因为ZnCl2加热时水解,反应方程式为ZnCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+ZnO+(x-1)H2O;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,实验证明脱水时发生了氧化还原反应方案为:
方法1:取少量FeCl3•6H2O于试管中,加入SOCl2,振荡;再往试管中加水溶解,然后滴加BaCl2溶液,若生成白色沉淀则证明脱水过程发生了氧化还原反应.
方法2:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象则证明脱水过程发生了氧化还原反应.
方法3:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀则证明脱水过程发生了氧化还原反应,
故答案为:方法1:取少量FeCl3•6H2O于试管中,加入SOCl2,振荡;再往试管中加水溶解,然后滴加BaCl2溶液,若生成白色沉淀则证明脱水过程发生了氧化还原反应.
方法2:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象则证明脱水过程发生了氧化还原反应.
方法3:取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡;再往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀则证明脱水过程发生了氧化还原反应.
点评 本题考查物质制备实验、实验方案设计、对原理与操作的分析与评价、化学计算等,关键是对实验原理的理解,较好地考查学生实验能力、计算能力、知识迁移运用能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
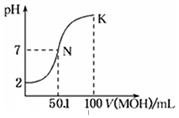 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )| A. | HA的电离方程式为:HA=H++A- | |
| B. | MOH为一元弱碱 | |
| C. | K点对应的溶液中有:c(MOH)+c(M+)=0.02mol•L-1 | |
| D. | N点对应的溶液中有:c(M+)=c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
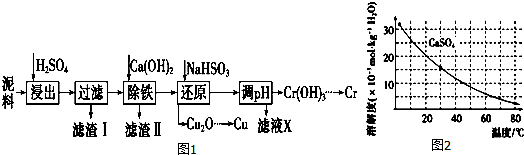
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.
如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
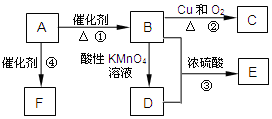 有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.
有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com