
【题目】石墨可以在一定条件下转化为金刚石,这一变化属于( )
A. 氧化还原反应 B. 离子反应 C. 化学变化 D. 物理变化
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下列反应可用于合成CH3OH:
![]()
(1)Mn2+基态核外电子排布式为____________。
(2)与NO3-互为等电子体的分子为_______(写化学式)。
(3)CO32-的空间构型是________(用文字描述)。
(4)1molCH3OH中含有σ键的数目为______mol。CH3OH与H2O可以任意比互溶,除因为它们都是极性分子外,还因为________。
(5)锰元素的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A.KMnO4
B.Ca(ClO)2
C.Cl2
D.H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液。
(1)已知:黄铁矿中的硫元素在酸性条件下可被![]() 氧化成
氧化成![]() ,若生成标准状况下3.36 L ClO2气体,至少需要黄铁矿的质量为 。
,若生成标准状况下3.36 L ClO2气体,至少需要黄铁矿的质量为 。
(2)工业上以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品3.0 g,通过反应和吸收获得200 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.040 0 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。
①写出ClO2溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式 。
②试计算ClO2的“产率”(写出计算过程) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖,
其中属于电解质的是 , 属于强电解质的是 . 能导电的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比2∶3∶3配制浓硫酸、乙醇和乙酸的混合溶液。
②按图甲连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管5 ~ 10 min。
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置。
请根据题目要求回答下列问题:

(1)乙酸分子中所含官能团的名称是______________________。
(2)配制该混合液时,滴加药品的顺序是_______________________________。
(3)浓硫酸的主要作用是________,试管B中饱和碳酸钠溶液的作用是__________。
(4)导管不能插入到Na2CO3溶液中的原因是_____________________________。
(5)做此实验时,有时还向A试管里加入几块碎瓷片,其目的是________________。
(6)指出步骤③所观察到的现象:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大马酮是一种主要用于高级化妆品和食品的香料,可通过紫罗兰酮A以下列方法合成:
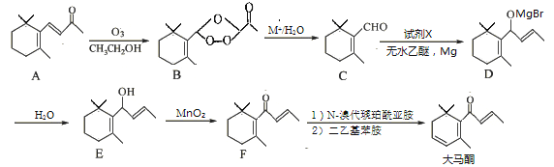
(1)B中的含氧官能团名称为 和 。
(2)D→E的反应类型为 。
(3)试剂X的分子式为C3H5Br,X的结构简式为 。
(4)写出同时满足下列条件的F的一种同分异构体的结构简式 。
①能与FeCl3溶液发生显色反应;
②分子中只有5种不同化学环境的氢。
(5)请以氯化苄![]() 和溴乙烷为原料制备苯丙烯
和溴乙烷为原料制备苯丙烯 ![]() ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:

(1)Na2MoO4·2H2O中钼元素的化合价是____。结晶得到的钼酸钠晶体是粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是________(填名称)。
(2)灼烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2→MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0 g MoO3,反应中转移电子的数目为______。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是 (填序号)。
a. Ca(OH)2 b. HNO3 c. Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_______________________。
能提高该反应速率的措施有_______(填序号)。
a.将粗产品粉碎 b.降低碳酸钠溶液的浓度 c.适当升高温度
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式________________。
(6)已知钼酸钠溶液中c(![]() )=0.40 mol·L1,c(
)=0.40 mol·L1,c(![]() )=0.52 mol·L1。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去
)=0.52 mol·L1。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去![]() 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时,![]() 的去除率是_______。[已知Ksp(BaCO3)=2.6×109、Ksp(BaMoO4)=4.0×108,忽略溶液的体积变化]
的去除率是_______。[已知Ksp(BaCO3)=2.6×109、Ksp(BaMoO4)=4.0×108,忽略溶液的体积变化]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
反应原理:
反应物与产物的物理性质:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)实验过程中可能发生的有机副反应的方程式为________________________________。
(2)根据上述资料,装置__________最适宜用来完成本次制备实验。



A B C
(3)制备粗产品
将5 mL________加入试管A中,再加入l0 mL_______,摇匀后放入碎瓷片,缓慢加热至反应完全。
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等。粗产品需依次经过水洗,加碳酸钠溶液洗涤以及第二次水洗。在此过程中加入碳酸钠溶液的目的是_____________;分液时,环己烯应从分液漏斗的_____(填“上”或“下”)口取出。
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入右图所示装置的____________(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为 。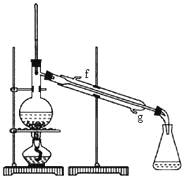
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com