
| A. | 放热反应 | B. | 吸热反应 | C. | 离子反应 | D. | 不可逆反应 |
分析 由于N2+3H2$?_{催化剂}^{高温高压}$2NH3属于放热反应,即1mol氮气和3mol氢气的总能量大于2mol氨气的能量,据此分析2NH3?N2+3H3反应中反应物和生成物的能量的大小关系.
解答 解:A、由于N2+3H2$?_{催化剂}^{高温高压}$2NH3属于放热反应,即1mol氮气和3mol氢气的总能量大于2mol氨气的能量,故2NH3?N2+3H3反应中反应物的总能量小于生成物的总能量,则反应吸热,故A错误;
B、反应吸热,故B正确;
C、此反应中氮气、氢气和氨气均不是电解质,无离子参与,故不是离子反应,故C错误;
D、此反应在相同条件下,既能正向进行又能逆向进行,故为可逆反应,故D错误.
故选B.
点评 本题考查了反应吸放热的判断和离子反应等的判断,应注意到一个反应,如果正反应吸热,则逆反应放热,反之成立.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 钢铁设备上连接铜块可以防止钢铁腐蚀 | |
| B. | 石英容器可盛放任何酸 | |
| C. | 生活中使用明矾净水,除去水中的悬浮的微小颗粒 | |
| D. | 向NaOH溶液中滴加FeCl3溶液制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭在空气中燃烧发白光、放热 | |
| B. | 氧化反应是指物质与氧气发生的化合反应 | |
| C. | 凡是在空气中不能燃烧的物质,在纯氧中也不能燃烧 | |
| D. | 蜡烛燃烧、食物腐败都是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
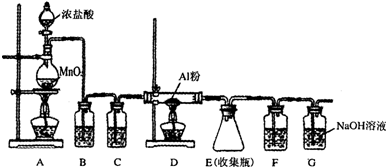
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ).
).
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第八周期ⅢA族 | B. | 第六周期ⅤA族 | C. | 第七周期ⅣB族 | D. | 第七周期ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锌铁皮镀层受损后,铁比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)增大 | |
| D. | 一定条件下水由气态变为液态是熵增加的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.8 g N02与足量水反应,转移电子数目为0.2 NA | |
| B. | 标准状况下,22.4 L溴苯中含有氢原子数目为5NA | |
| C. | 500 mL 2 mol/L NH4N03溶液中,含有NH4+数目为NA | |
| D. | 用惰性电极电解足量CuS04溶液,生成22.4 L气体时转移电子数目为4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com