
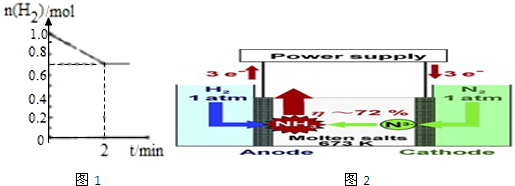
| 3 |
| 2 |
| ③ |
| 2 |
| 0.3mol |
| 3L |
| 0.1mol/L |
| 2min |
| 2 |
| 3 |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| x2 |
| (1-x)2 |
| 0.625mol/L |
| 1mol/L |


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
| A、氧化产物与还原产物的物质的量之比为2:1 |
| B、铁粉剩余,溶液呈浅绿色,Cl-基本不变 |
| C、向溶液中滴入无色KSCN溶液,仍无色 |
| D、Fe2+和Fe3+物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
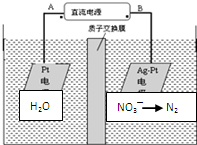 (1)化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO
(1)化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 甲 | 乙 | 丙 |
| A | Al2O3 | HCl | NaOH |
| B | SO2 | Ca(OH)2 | Na2CO3 |
| C | Mg | FeSO4 | HNO3 |
| D | SiO2 | NaOH | C |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl |
| B、MgCl2 |
| C、KCl |
| D、CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常见的氧化物:水、氧化铜、熟石灰 |
| B、分散系-空气、水玻璃、盐酸 |
| C、非电解质-液氯、乙醇、NH3 |
| D、强氧化剂-盐酸、硫酸、硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是重要的制药中间体,如果以2-溴丙烷为初始原料,通过多步反应制得.需要经过的反应依次是( )
)是重要的制药中间体,如果以2-溴丙烷为初始原料,通过多步反应制得.需要经过的反应依次是( )| A、取代-氧化-加成-消去 |
| B、消去-取代-加成-氧化 |
| C、消去-加成-取代-氧化 |
| D、取代-消去-加成-氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、每个松萝酸分子中含有3个酚羟基 |
| B、每个松萝酸分子中含有1个手性碳原子 |
| C、松萝酸能发生加成、氧化、水解、消去等反应 |
| D、1mol松萝酸最多能与8molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池总反应为:Mg+H2O2=Mg(OH)2 |
| B、正极发生的电极反应为:H2O2+2H++2e-=2H2O |
| C、工作时,正极周围海水的pH增大 |
| D、电池工作时,溶液中的H+向负极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com