
①仅用蒸馏水就可鉴别蔗糖、硫酸铜粉未、碳酸钙粉未;
②用分液漏斗分离甘油和水的混合物;
③稀释浓硫酸时,将浓硫酸沿烧杯壁慢慢注入水中并不断搅拌;
④用玻璃棒蘸取溶液滴在pH试纸中央,测该溶液的pH;
⑤配制一定物质的量浓度的溶液,需要的玻璃仪器只有容量瓶和烧杯;
⑥在250mL烧杯中,加入216mL水和24g NaOH固体,配制10% NaOH溶液。
A. ①②④⑥ B. ①④⑤⑥ C. ①③④⑥ D. ②③④⑤
科目:高中化学 来源: 题型:选择题
| A. | 最外层有两个电子的原子一定在IIA 族 | |
| B. | IA族均为碱金属 | |
| C. | 同一周期核电荷数越大原子半径越大 | |
| D. | 同一主族核电荷数越大元素金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的性质很活泼,它与氢气混合后立即发生爆炸 | |
| B. | 可以用氢氧化钙溶液吸收实验室制取氯气时多余的氯气 | |
| C. | 检验Cl2中是否混有HCl方法是将气体通入硝酸银溶液 | |
| D. | 除去Cl2中的HCl气体,可将气体通入饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①,最好用硫酸来溶解烧渣 | |
| B. | 步骤②,涉及的离子反应为FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+ | |
| C. | 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾 | |
| D. | 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:实验题
如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
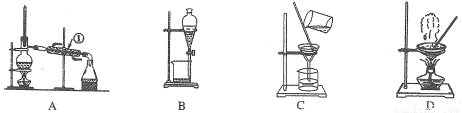
(1)从氯化钾溶液中得 到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的C1?等杂质,选择装置 。
到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的C1?等杂质,选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名 称为 。
称为 。
(3)装置A中①的名称是 ,进水的方向是从 口进水。装置B在分液时为使液体顺利滴下,除打开上口活塞外,还应进行的具体操作是 。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:

粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④加入略过量的盐酸 ⑤溶解 ⑥过 滤 ⑦蒸发
滤 ⑦蒸发
正确的操作顺序是 (填写序号)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(5)用化学方程式回答加入Na2CO3溶液的作用:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度时,正反应速率加快,逆反应速率减慢,平衡逆向移动 | |
| B. | 若x=1,新平衡下E转化率为50% | |
| C. | 若x=2,新平衡下F的平衡浓度为0.5a mol/L | |
| D. | 若x=2,换成恒压容器,则达到平衡所需时间比恒容容器所需时间短 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A. | t3 时降低了温度 | |
| B. | t2时加入了催化剂 | |
| C. | t5时增大了压强 | |
| D. | t4~t5时间内 X 或 Y 的转化率最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的摩尔质量等于其相对原子质量或相对分子质量 | |
| B. | 摩尔是7个基本物理量之一 | |
| C. | 46 g NO2和N2O4的混合物中含有的氮原子数为NA | |
| D. | 1molCO2所占的体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com