
【题目】关于溶液的下列说法正确的是( )
A.等体积、对物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>c(HX)>c(X﹣)>c(H+)>c(OH﹣)
B.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32﹣)的大小关系为:②>④>③>①
C.往0.1mol/L CH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中 ![]() 增大
增大
D.Na2CO3溶液中,2c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
【答案】B
【解析】解:A.如果溶液呈酸性,则HX的电离程度大于X﹣的水解程度,所以c(HX)<c(X﹣),根据物料守恒得c(Na+)<c(X﹣),溶液中离子浓度大小顺序是c(X﹣)>c(Na+)>c(HX)>c(H+)>c(OH﹣),故A错误; B.由于④发生互促水解,水解程度较大,则c(CO32﹣)的大小为②>④,①为二元弱酸,c(CO32﹣)最小,则c(CO32﹣)的大小关系为:②>④>③>①,故B正确;
C.往0.1mol/L CH3COOH溶液中通入少量HCl,氢离子浓度增大醋酸的电离平衡向着逆向移动,但 ![]() 为平衡常数的倒数,温度不变平衡常数不变,则该比值不发生变化,故C错误;
为平衡常数的倒数,温度不变平衡常数不变,则该比值不发生变化,故C错误;
D.Na2CO3溶液中,根据物料守恒可得:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)+2c(H2CO3),故D错误;
故选B.


科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液,造成浓度偏高的操作是
A.定容时,滴加蒸馏水超过刻度线
B.定容时,眼睛俯视刻度线
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
D.定容时,眼睛仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为倡导“低碳”,减小CO2对环境的影响,需对CO2进行创新利用研究.T1℃使,将将9mol CO2和12mol H2充入3L密闭容器中,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p0 . 改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示.下列说法错误的是( ) 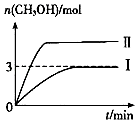
A.曲线Ⅱ对应的条件改变是增大压强
B.T2℃时,上述反应平衡常数为0.52,则T2>T1
C.在T1℃,若起始时向容器充入4.5 mol CO2、6 mol H2 , 平衡时容器内压强P1> ![]()
D.在T1℃,若起始时向容器中充入4.5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作合理的是( )
A. 用酒精萃取碘水中的碘单质 B. 用托盘天平称取5.20 g氯化钠
C. 用100 mL量筒量取5.20 mL盐酸 D. 用坩埚钳取下灼热的蒸发皿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.配制一定物质的量浓度的溶液,向容量瓶加水至液面离刻度线1~2 cm时,改用胶头滴管定容
B.向某溶液中先加入Ba(NO3)2溶液,再加入足量的HNO3溶液,产生白色沉淀,则该溶液中一定含有SO ![]()
C.分液操作时,将下层液体先放出,然后关闭旋塞,将上层液体从上口倒出
D.将油脂与氢氧化钠溶液混合充分反应后,再加入热的饱和食盐水,则可析出肥皂的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式_____________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种酸,写出并配平化学反应方程式_________________________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_________________________________________________。
(2)下列有关硅材料的说法正确的是________ 。
A.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高,硬度很大
(3)自然界中硅酸盐种类多,结构复杂,通常用二氧化硅和金属氧化物的形式来表示其组成.如正长石(KAlSi3O8),氧化物形式为_________________________________
(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为_____________,水玻璃在工业上有许多用途,试举出一例____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用0.4molL﹣1 NaOH溶液480mL.配制方法如下:
(1)用托盘天平准确称量g 固体NaOH;
(2)将称量好的NaOH固体放在500mL大烧杯中,倒入约300mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待后,将烧杯中的溶液注入容量瓶中;
(3)用少量蒸馏水洗涤烧杯次,洗涤后的溶液 , 轻轻晃动容量瓶,使溶液混合均匀;
(4)向容量瓶中加入蒸馏水,到液面时,改用加蒸馏水至液面最低点与刻度线相切.盖好瓶塞,;
(5)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是 , 偏低的是 , 对实验结果没有影响的是(填各选项的序号). A.所用的NaOH中混有少量Na2O
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度为 mol/L.
(2)某化学小组进行硫酸酸性实验探究时,需要240mL4.6mol/L的稀硫酸,则需要取上述的浓硫酸 mL.
(3)将上述浓硫酸进行稀释的实验操作是 .
(4)在配制4.6mol/L稀硫酸的过程中,下列情况对所配制硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)?
①未经冷却趁热将溶液注入容量瓶中: ;
②定容时仰视读数: ;
③用量筒量取浓硫酸时俯视 ;
④移液时不慎将少量溶液滴在容量瓶外面: .
(5)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水至距刻度线1~2cm时,应 ;
②加蒸馏水时不慎超过了刻度,应 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com