
| 3.6mol |
| 6.0mol |
| 1.8mol |
| 1.8mol+2.4mol+2.4mol |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
 (2011?南开区一模)能源开发、环境保护、资源利用等是当今社会的热门话题.请根据所学化学知识回答下列问题:
(2011?南开区一模)能源开发、环境保护、资源利用等是当今社会的热门话题.请根据所学化学知识回答下列问题:| 物 质 | CO | H2 | CH3OH |
| 浓度/(mol?L-1) | 1.2 | 1.0 | 0.6 |
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 ClO(g)+3H2(g)△H>0.
ClO(g)+3H2(g)△H>0. CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
查看答案和解析>>
科目:高中化学 来源: 题型:
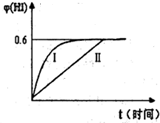
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:浙江省杭州高中2010届高三上学期第一次月考化学试题 题型:013
|
在一定温度下,发生可逆反应:2A(g)+2B(g)
| |
| [ ] | |
A. |
甲、乙两容器中的反应达到化学平衡时,若向两容器内各充入1 mol氩气,平衡均不移动 |
B. |
甲、乙两容器中的反应达到化学平衡时,C的体积分数相等 |
C. |
向甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的体积分数不变 |
D. |
向乙容器中再充入2 mol C和6 mol D,平衡后乙中物质C的浓度为原来的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com