
| A. |  如图可表示水分解过程中的能量变化 如图可表示水分解过程中的能量变化 | |
| B. | 若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g)△H=-a kJ/mol, Ⅱ: 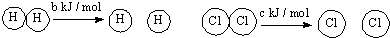 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为-a-b-c 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为-a-b-c |
分析 A、水分解是吸热过程;
B、燃烧热是1mol纯净的可燃物完全燃烧生成温度氧化物放出的热量;
C、某些放热反应需要加热才能反应,常温发生的反应不一定是放热反应;
D、依据焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算;断裂化学键吸热过程.
解答 解:A、反应物能量低于生成物能量,催化剂降低反应的活化能,加快反应速率,但不改变反应热;图象符合要求,故A正确;
B、反应生成的是一氧化碳是不稳定的氧化物,不符合燃烧热概念,故B错误;
C、某些放热反应需要加热才能反应,常温发生的反应不一定是放热反应,如Ba(OH)2•8H2O和NH4Cl反应是吸热反应,常温下进行,故C错误;
D、△H=bKJ/mol+cKJ/mol-2H-Cl键能=-aKJ/mol;所以H-Cl键能=$\frac{a+b+c}{2}$kJ/mol;断开1 mol H-Cl键所需吸收的能量为$\frac{a+b+c}{2}$kJ,故D错误;
故选A.
点评 本题考查反应热、燃烧热概念的理解应用,反应放热吸热的判断依据,键能计算焓变的方法应用,题目难度中等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )| A. | 放出1 638 kJ的热量 | B. | 吸收1 638 kJ的热量 | ||
| C. | 放出126 kJ的热量 | D. | 吸收126 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 环境问题 | 造成环境问题的主要物质 |
| A | 酸雨 | O3 |
| B | 温室效应 | CO2 |
| C | 南极臭氧层空洞 | SO3 |
| D | 光化学烟雾 | N2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个原子或多个原子之间的相互作用叫化学键 | |
| B. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 只有金属元素和非金属元素化合时才能形成离子键 | |
| D. | 离子化合物中一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号)
(1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号) .其最高价氧化物对应的水化物的化学式是H2SO4.
.其最高价氧化物对应的水化物的化学式是H2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当x≤4时,均为气体(常温常压下) | |
| B. | y一定是偶数 | |
| C. | 分别燃烧1mol,耗氧气(x+$\frac{y}{4}$)mol | |
| D. | 在150℃时的密闭容器中完全燃烧后恢复到原温度,测得的压强一定比燃烧前增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 乙醇(mol) | 乙酸(mol) | 乙酸乙酯(mol) |
| 1 | 2 | 2 | 1.33 |
| 2 | 3 | 2 | 1.57 |
| 3 | 4 | 2 | x |
| 4 | 5 | 2 | 1.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:O2-<F-<Na+<Li+ | B. | 第一电离能:He<Ne<Ar | ||
| C. | 分子中的键角:CH4>H2O>CO2 | D. | 共价键的键能:C-C<C=C<C≡C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com