
| A. | $\frac{b-a}{b}$ | B. | $\frac{2(b-a)}{b}$ | C. | $\frac{3a-2b}{b}$ | D. | $\frac{2b-3a}{b}$ |
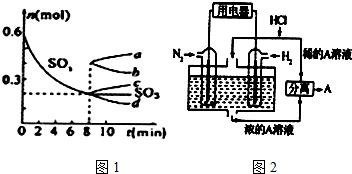
分析 发生反应为2SO3?2SO2+O2,反应前后体积变化为(b-a)L,设反应消耗的SO3为x,利用差量法计算出反应消耗的SO3的体积,然后计算出反应后剩余三氧化硫的体积,最后计算出bL气体中SO3的体积分数.
解答 解:反应前后体积变化为(b-a)L,设反应消耗的三氧化硫为x,则:
2SO3?2SO2+O2 △V
2 2 1 1
x (b-a)L
则:x=$\frac{2(a-b)L}{1}$=2(a-b)L,
则bL气体中含有SO3的体积为:aL-2(b-a)L=(3a-2b)L,
所以该bL气体中SO3的体积分数为:$\frac{(3a-2b)L}{bL}$=$\frac{3a-2b}{b}$,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握差量法在化学计算中的应用方法,试题培养了学生的化学计算能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
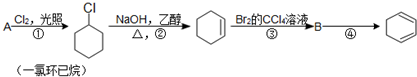
 ,名称是环己烷.
,名称是环己烷. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO | ||
| C. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ | D. | Cu(OH)2 $\frac{\underline{\;△\;}}{\;}$CuO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl+NaOH$\frac{\underline{\;△\;}}{\;}$NH3↑+H2O+NaCl | B. | 3CO+Fe2O3$\frac{\underline{\;△\;}}{\;}$2Fe+3CO2 | ||
| C. | Cl2+2KBr═Br2+2KCl | D. | NH3+CO2+H2O═NH4HCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com