
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 实验室制硝基苯:先加入苯,再加浓硫酸,最后滴入浓硝酸 | |
| C. | 提取溶解在水中的少量碘:加入CCl4振荡、静置、分层后取出有机层再分离 | |
| D. | 检验某溶液中是否含有甲醛:在盛有2mL10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热 |
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:填空题
 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x﹕m﹕n=1﹕2﹕1 | B. | m﹕n=2﹕1 | C. | m≥2x+2 | D. | m<2x+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
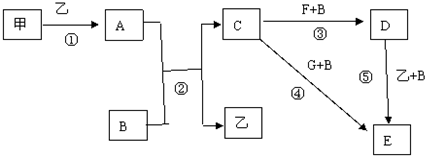
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,l L 0.50 mol/LNH4C1溶液与2 L0.25mol/LNH4C1溶液NH4+的离子数均为0.5NA | |
| B. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数为NA | |
| D. | pH=5的NaHSO4溶液中水电离出的氢离子数目为10-5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列说法正确的是( )
在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | X极上发生的是还原反应 | |
| C. | 溶液中氢离子向X极移动 | |
| D. | 若两电极都是金属,则它们的活动性顺序为X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ | B. | Fe3+ | C. | Fe2+ | D. | H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si可用于制作计算机芯片,也是光导纤维的主要成分 | |
| B. | “硅胶”可用作袋装食品和瓶装药品的干燥剂,也可用作催化剂的载体 | |
| C. | 硅酸钠可用于制备木材防火剂 | |
| D. | 用碳酸氢钠可以焙制糕点、面包 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com