
【题目】(1)写出CH4和Cl2在光照的条件下生成CH3Cl的化学反应方程式_________
(2)写出如图所示原电池的电极方程式:
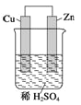
负极:_______________________
正极:_______________________
【答案】CH4+Cl2![]() CH3Cl+HCl Zn-2e-=Zn2+ 2H++2e-= H2↑
CH3Cl+HCl Zn-2e-=Zn2+ 2H++2e-= H2↑
【解析】
(1)发生取代反应反应生成一氯甲烷和HCl;
(2)根据原电池工作原理写出负极、正极的电极反应。
(1)甲烷与氯气在光照的条件下发生取代反应,第一步是1个氯原子替换出1个氢原子,另一个氯原子则与氢原子结合生成氯化氢,反应方程式为CH4+Cl2![]() CH3Cl+HCl,
CH3Cl+HCl,
故答案为:CH4+Cl2![]() CH3Cl+HCl;
CH3Cl+HCl;
(2)反应Zn+2H+═Zn2++H2↑中,锌在负极失去电子生成锌离子,电极反应为:Zn-2e-═Zn2+;氢离子在正极得到电子生成氢气,发生得到电极反应为:2H++2e-= H2↑,
故答案为:Zn-2e-=Zn2+;2H++2e-= H2↑。


科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如下图所示。
![]()
(1)铝氢化钠遇水发生剧烈反应,其反应的化学方程式为_____________________。
(2)AlCl3与NaH反应时,需将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因是__________________。
(3)实验室利用下图装置制取无水AlCl3。
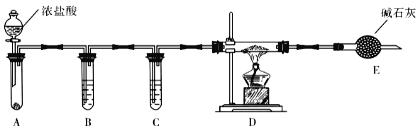
①A中所盛装的试剂是_______________。
②点燃D处酒精灯之前需排除装置中的空气,其操作是______________________。
(4)改变A和D中的试剂就可以用该装置制取NaH,若装置中残留有氧气,制得的NaH中可能含有的杂质为____________
(5)现设计如下四种装置,测定铝氢化钠粗产品(只含有NaH杂质)的纯度。

从简约性、准确性考虑,最适宜的装置是_________(填编号)。称取15.6g样品与水完全反应后,测得气体在标准状况下的体积为22.4L,样品中铝氢化钠的质量分数为___________。(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是( )

A. 测量原理示意图中,电流方向从Cu流向Ag2O
B. 负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O
C. 电池工作时,OH-向正极移动
D. 2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八种短周期元素x、y、z、d、e、f、g、h原子序数依次递增,其原子半径、最高正价或最低负价如下表所示。
x | y | z | d | e | f | g | h | |
原子半径/nm | 0.037 | 0.077 | 0.075 | 0.074 | 0.186 | 0.143 | 0.102 | 0.099 |
最高正化合价或最低负化合价 | +1 | +4 | +5 | -2 | +1 | +3 | -2 | -1 |
回答下列问题:
(1)比较d、f常见离子的半径大小(用化学式表示,下同):_______>________;比较g、h的最高价氧化物对应水化物的酸性强弱:________>__________。
(2)由x、d两种元素组成18电子的分子,其电子式为____________,经测定其为二元弱酸,其酸性比碳酸弱,写出其第一步电离的电离方程式____________。
(3)y、d、e组成物质e2yd3的水溶液呈碱性,其原因是____________________(用离子方程式表示),电解该物质e2yd3的溶液,原理如图所示。

其中,离子交换膜使用的是__________(填“阳离子交换膜”或“阴离子交换膜”),阴极产生的物质A的化学式为____________。
(4)f的粉末在1000℃时可与N2反应制备fN。在f的粉末中添加少量NH4Cl固体并充分混合,有利于fN的制备,其主要原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中指出“持续实施大气污染防治行动,打赢蓝天保卫战”。SO2为大气污染物,研究它的性质对治理具有重要意义。在铝基氧化铜作催化剂时,可利用天然气脱除二氧化硫,并回收单质硫(熔点为112.8℃,沸点为444.6℃)。
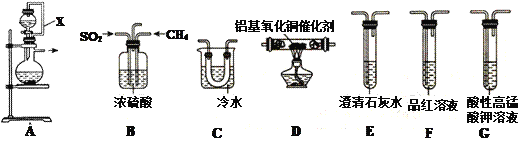
(1)①装置中导管X的作用是:______________________________。
②用装置A制取SO2,则试剂的组合最好是_________(填字母)。
a. 18.4 mol/L H2SO4+Cu b. 4 mol/L HNO3+Na2SO3 c. 60% H2SO4+K2SO3
③水与Al4C3在装置A中制取甲烷,其化学方程式为:________________。
(2)利用制得的CH4和SO2并结合B~G装置验证反应:CH4+2SO2 .![]() 2S+CO2+2H2O生成的单质S和CO2。
2S+CO2+2H2O生成的单质S和CO2。
①B装置有三个作用,分别是________________________、充分混合CH4和SO2、观察气泡以便调节CH4和SO2的流速比约为1∶2。
②实验装置依次连接的合理顺序为B、_____________________(每个装置只用一次)。
③证明有CO2产生的现象为_____________________________。
④G装置中发生反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 2.8 g环已烷含共价键数目为0.4NA
B. 过氧化钠与水反应,生成0.1 mol氧气时,转移的电子数为0.4NA
C. 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA
D. 用惰性电极电解CuSO4溶液后,如果加入0.1 molCu(OH)2能使溶液复原,则电路中转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是
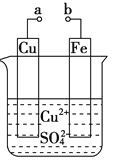
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A+B―→C(放出能量)分两步进行:①A+B―→X(吸收能量),②X―→C(放出能量)。下列示意图中表示总反应过程中能量变化的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com