
分析 (1)根据配制一定物质的量浓度溶液的操作步骤选取实验仪器;
(2)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸溶液的体积;根据浓硫酸的体积选取量筒,注意所选量筒的容积应稍大于或等于量取溶液的体积;
(3)依据配制溶液体积选择容量瓶规格,玻璃棒在移液时起引流作用,定容时用胶头滴管逐滴滴加;
(4)依据配制一定物质的量浓度溶液的操作步骤判断;分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
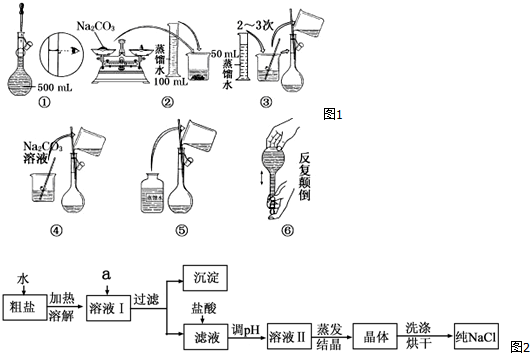
解答 解:(1)配制一定物质的量浓度硫酸溶液的一般步骤有:量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、500ml容量瓶,所以用不到的仪器有烧瓶、托盘天平、药匙;
故答案为:②⑦⑧;
(2)质量分数98%密度为1.84g•cm-3浓H2SO4的物质的量浓度=$\frac{1000×1.84×98%}{98}$=18.4mol/L;
设需要浓硫酸溶液的体积为V,0.25mol•L-1×500ml=V×18.4mol/L,解得:V=6.8ml,应选择10ml量筒;
故答案为:6.8mL,①;
(3)配制500mL0.25mol/L的稀H2SO4,首先需要计算用到的浓硫酸体积,然后量取需要浓硫酸,将浓H2SO4加适量蒸馏水稀释,冷却片刻,随后全部转移到500mL的容量瓶中,转移时应用玻璃棒 引流,转移完毕,用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1~2cm处.改用 胶头滴管加蒸馏水到瓶颈刻度的地方,使溶液的凹液面正好与刻度线相切.振荡、摇匀后,装瓶、贴签;
故答案为:500,引流,胶头滴管;
(4)①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏高,故选;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故选;
③稀释浓硫酸应将浓硫酸缓缓注入水中,操作错误,故不选;
④定容时,加蒸馏水超过标线,又用胶头滴管吸出,导致溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;
⑤转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致溶液体积偏大,溶液浓度偏低,故不选;
⑦定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选;
故答案为:①②⑦.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制原理和过程是解题关键,转移容量瓶的选择和使用注意事项,注意误差的分析.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解平衡的本质是结晶速率等于溶解速率 | |
| B. | 在不饱和溶液中,溶质的溶解速率小于结晶速率 | |
| C. | 在饱和溶液中,晶体的质量不改变,形状可能改变 | |
| D. | 当物质达到溶解平衡时,不改变外界条件,溶液的浓度也不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定终点的pH值一定等于7 | |
| B. | 滴定实验中锥形瓶不可用待测液润洗 | |
| C. | 滴定实验中,KMnO4溶液应放在碱式滴定管中 | |
| D. | 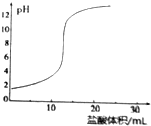 用盐酸滴定NaOH溶液的滴定曲线如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | B. | 金刚石比石墨稳定 | ||
| C. | 石墨转化为金刚石是一个物理变化 | D. | 石墨和金刚石是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
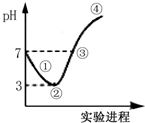 常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 从反应开始至②点,发生反应的离子方程式为:Cl2+H2O═ClO-+2H++Cl- | |
| B. | ③处表示氯气和NaOH溶液恰好完全反应 | |
| C. | ②点所表示的溶液中所存在的具有氧化性的含氯元素的微粒主要有:Cl2、HClO、ClO- | |
| D. | 从反应开始至②点可用pH试纸测定溶液的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com