
【题目】当光束通过下列分散系时,能观察到丁达尔效应的是( )
A.泥浆B.CuSO4溶液C.Fe(OH)3胶体D.酒精溶液
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )

A. 汉黄芩素的分子式为C16H13O5
B. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
C. 1 mol该物质与溴水反应,最多消耗1 mol Br2
D. 该物质遇FeCl3溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。氰化钠同时也是一种剧毒物质,严重危害人类健康,一旦泄露需要及时处理。
(1)已知25℃时,相同物质的量浓度的NaHCO3、NaCN、Na2CO3溶液pH依次增大,则向NaCN溶液中通入少量CO2,发生反应的离子方程式是________。
(2)若氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
①常温下,氰化钠能与过氧化氢溶液反应,生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式 _____________;
②已知:氰化钠与硫代硫酸钠的反应是NaCN+Na2S2O3=NaSCN+Na2SO3,当1.96gNaCN完全反应时转移的电子物质的量是__________;实验室中硫氰化钠可以代替硫氰化钾检验______________。
(3)现要检测某经过处理过的废水中氰化钠的含量。已知:废水中氰化钠最高排放标准是0.50mg/L;Ag++2CN—=[Ag(CN)2]—(无色溶液),Ag++I—=AgI↓,CN—优先与Ag+反应。
实验如下:取30.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂;用1.00×10—4mol·L—1的标准AgNO3溶液滴定,达到滴定终点时,消耗AgNO3溶液的体积为1.50mL。(假设废水中没有其它成分参与反应。)
①滴定达到终点时的现象是____________________________________;
②该废水________(填“能”或“不能”)直接排放到河流中,通过计算结果说明得出上述结论的依据:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中能大量共存的一组离子是( )
A.NH4+、Ba2+、Brˉ、CO32ˉ
B.Clˉ、NO3ˉ、Fe2+、H+
C.K+、Na+、SO42ˉ、MnO4ˉ
D.Na+、H+、SO42ˉ、HCO3ˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池(MPC)处理技术是通过微生物的作用去除污染物,该技术可广泛应用于去除土壤中有机污染物。一种土壤微生物燃料电池的纵截面如图所示,下列说法不正确的是
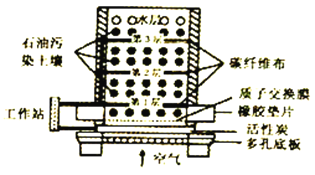
A. 电流从活性炭电极经工作站流向碳纤维布电极
B. 有机污染物在电池负极上氧化为对环境无害的物质
C. 活性炭能有效吸附空气,提高电池的工作效率
D. 该电池的正极反应式为O2+4e-↓+2H2O==4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_____________,其基态原子的电子排布式为[Ar]_______。
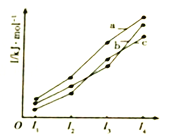
(2)如图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_______(填标号)。
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是____________,1mol(X2H5O)3Z=O分子中含有的σ键与π键的数目比为__________________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为_____。
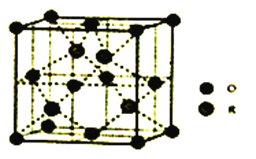
(5)某R的氧化物晶胞结构如图所示。该物质的化学式为_______________。已知该晶体密度为pg·cm-3,距离最近的两个原子的距离为dpm,则R的相对原子质量计算表达式为___________________________(已知lpm=10-12m,阿伏加德罗常数为NA)。
(6)X形成的一种常见单质,性质硬而脆,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计了如下从海带灼烧后的海带灰中提取碘单质的流程:
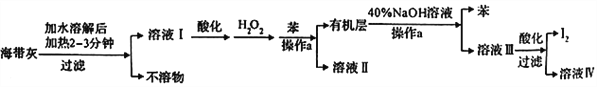
(1)溶解海带灰时要加热煮沸2~3min的目的是_________,操作a的名称是 _______。
(2)向酸化的溶液I中加入H2O2的目的是__________________________________。
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,则发生反应的化学方程式是________________________________。
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是______。
a.热水 b.乙醇 c.冷水 d.二硫化碳
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI。取5.0g产品,配制成100ml溶液。取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0.050mol·L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗Na2S2O3标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是________,碘单质在产品中的质量分数是________% 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com