
| A、在标准状况下,0.25NA个氯气分子所占体积是5.6L |
| B、NA个氧分子和2NA个氢分子的质量比等于16:1 |
| C、在常温常压下,22.4L氙气含有的原子数为NA |
| D、在标准状况下,22.4L任何气体单质所含的原子数均为2NA |
| 0.25NA |
| NA |


科目:高中化学 来源: 题型:
A、用惰性电极电解氯化镁溶液:2Cl-+2H+
| ||||
| B、用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | ||||
C、碳酸钠的水解:
| ||||
D、硝酸银溶液中滴加过量氨水:Ag++NH3?H2O═AgOH↓+N
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷和氯气反应生成-氯甲烷,苯与硝酸反应生成硝基苯,两者反应类型相同 |
| B、二氧化碳和干冰互为同分异构体 |
| C、“地沟油”在氢氧化钠作用下制取肥皂的反应为加成反应 |
| D、为准确测定盐酸和NaOH溶液反应的中和热,所用酸和碱的物质的量应相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
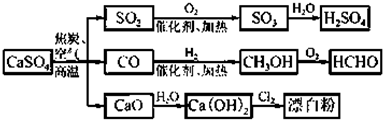
| A、CO、SO2、SO3均是酸性氧化物 |
| B、用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
| C、工业上利用Cl2和澄清石灰水反应来制取漂白粉 |
| D、除去与水反应,图示转化反应均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用电解熔融氯化钠的方法得到活泼金属钠 |
| B、在加热的情况下用氢气还原Al203得到金属铝 |
| C、用铝热反应原理炼得熔点较高的金属铬 |
| D、热分解法直接加热HgO得到金属Hg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入空气的一极是正极,电极反应为:O2+4e-=2O2- | ||||
B、电池的总反应为2C4H10+13O2
| ||||
| C、在熔融电介质中,O2-由负极移向正极 | ||||
| D、通入丁烷的一极是负极,电极反应为 2C4H10-52e-+26O2-=8CO2+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该有机物的分子式为CH4 |
| B、该有机物的分子式一定为C2H6 |
| C、该有机物的分子式一定为C2H6O |
| D、该有机物的分子中碳原子和氢原子的个数比为1:3,可能含有氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com