
| 需加入的试剂 | 操作方法 | |
| CH3CH2OH(水) | 蒸馏 | |
| 乙烷(乙烯) | 洗气 | |
| 乙酸乙酯(乙酸,乙醇) |
分析 CaO与水反应后,增大与乙醇的沸点差异;
乙烯与溴水反应,而乙烷不能;
碳酸钠溶液与乙酸反应,吸收乙醇,降低乙酸乙酯的溶解度.
解答 解:CaO与水反应后,增大与乙醇的沸点差异,则选择试剂为a,然后蒸馏可分离;
乙烯与溴水反应,而乙烷不能,则选择试剂为b,然后洗气可分离;
碳酸钠溶液与乙酸反应,吸收乙醇,降低乙酸乙酯的溶解度,则选择试剂为c,然后分液可分离,
故答案为:
| 需加入的试剂 | 操作方法 | |
| CH3CH2OH(水) | a | 蒸馏 |
| 乙烷(乙烯) | b | 洗气 |
| 乙酸乙酯(乙酸,乙醇) | c | A |
点评 本题考查混合物分离提纯,为高频考点,侧重于学生的分析能力与应用能力的考查,注意有机物的性质及混合物分离方法的选择,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子中所有原子都在同一平面内 | |
| B. | 能与溴水发生加成反应使其褪色 | |
| C. | 能与浓HNO3在一定条件下发生取代反应 | |
| D. | 能与酸性KMnO4溶液反应使其褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜丝燃烧法可确定有机物中是否存在氮、氯和硫等元素 | |
| B. | 减压分馏、常压分馏都是物理变化 | |
| C. | 甲烷与氯气在光照条件下反应是一个自由基型链反应 | |
| D. | 液化石油气、天然气都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑥ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
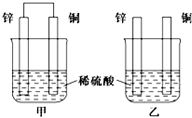 (1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
(1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W三种元素组成化合物的化学式可能为ZWY | |
| B. | Z与Y、Z与W形成的化合物的化学键类型可能完全相同 | |
| C. | 简单离子的半径:R>W>Y>Z | |
| D. | 因非金属性Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com