
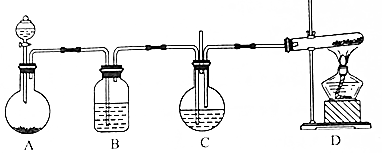
分析 由流程可知:A中由稀盐酸和石灰石制备二氧化碳,B盛放碳酸氢钠溶液,吸收二氧化碳中混有的氯化氢气体,D中为氢氧化钙与氯化铵共热制备氨气,氨气与二氧化碳在C中与氯化钙溶液反应制得纳米级碳酸钙,为了更好的吸收二氧化碳,故先铜氨气,氨气不能直接排放于空气中,需要进行尾气吸收,据此分析解答.
解答 解:(1)由仪器构造可知仪器a为分液漏斗;
故答案为:分液漏斗;
(2)氯化氢具有挥发性,盐酸与石灰石制备的二氧化碳中混有氯化氢气体,B中盛有饱和NaHCO3溶液除去氯化氢气体;
故答案为:除去二氧化碳中的氯化氢;
(3)实验室制取氨气采用氯化铵和氢氧化钙加热制的生成氯化钙、氨气和水,反应的方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)氨气极易溶于水,易于二氧化碳的吸收,所以应先通入氨气;
故答案为:NH3;
(5)氨气溶于水生成氨水,溶液呈碱性,二氧化碳是酸性气体,能和碱反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵,反应的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl;
故答案为:CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl;
(6)氨气不能直接排放于空气中,需要进行尾气吸收;
故答案为:缺少尾气处理装置.
点评 本题考查了物质的制备,侧重考查氨气、二氧化碳的实验室制法,难度不大,掌握实验的原理是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 稳定性:PH3>H2S>HCl | B. | 碱性:Al(OH)3>Mg(OH)2>NaOH | ||
| C. | 酸性:HIO4>HBrO4>HClO4 | D. | 非金属性:F>O>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 影响气体体积大小的主要因素为微粒数目与微粒间的距离 | |
| B. | 可利用MnO2和浓盐酸常温下反应制取氯气 | |
| C. | 相同温度下,在水中Na2CO3的溶解度小于NaHCO3 | |
| D. | 氧化还原反应的本质是存在元素化合价的升降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2═2 Fe3++I2+4Br- | |
| C. | NaHSO4溶液中滴入少量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2+H2O↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,化学反应速率加快,反应的△H也随之减小 | |
| B. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在“天宫二号”上蚕宝宝的“太空屋”形似胶囊(如图),两端的半球体由航天铝合金打造,中间部分采用透明有机玻璃,蚕宝宝由聚氨酯海绵包裹着.
在“天宫二号”上蚕宝宝的“太空屋”形似胶囊(如图),两端的半球体由航天铝合金打造,中间部分采用透明有机玻璃,蚕宝宝由聚氨酯海绵包裹着.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com