
| A、体系压强不再发生变化 |
| B、各组分的物质的量浓度不再改变 |
| C、各组分的质量分数不再改变 |
| D、反应速率vA:vB:vC:vD=m:m:p:q |


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、①④ | B、①② | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用电极电解少量的MgCl2溶液:2H2O+2Cl-
| ||||
| B、向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | ||||
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | ||||
| D、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
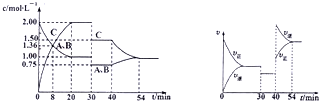
| A、前8minA的平均反应速率为0.08mol?L-1min-1 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30min时降低温度,40min时升高温度 |
| D、30-40min之间该反应增大了压强或使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、57 | B、47 | C、64 | D、293 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A是一种只含碳、氢、氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍.A可以和金属钠反应放出氢气并在一定条件下发生如图所示的变化.回答下列问题:
已知A是一种只含碳、氢、氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍.A可以和金属钠反应放出氢气并在一定条件下发生如图所示的变化.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 | ① | ② | ③ | ④ |
V(HNO3)/mL | 50 | 100 | 150 | 200 |
| V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子里含有苯环的化合物 |
| B、分子组成符合CnH2n-6 通式的一类有机物 |
| C、分子里含有一个或多个苯环的烃 |
| D、苯和苯的同系物的总称 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com