
| A. | 3 | B. | 4 | C. | 6 | D. | 8 |
分析 饱和一元醇能被催化氧化生成醛,则一定含-CH2OH,由分子式可知判断-C4H9的结构可确定同分异构体数目,以此来解答.
解答 解:饱和一元醇能被催化氧化生成醛,则一定含-CH2OH,由分子式可知还含烃基-C4H9,烃基有四种,则条符合条件的醇的同分异构体(不考虑立体异构)最多有4种:CH3CH2CH2CH2CH2OH、(CH3)2CHCH2CH2OH、CH3CH(CH3)CH2CH2OH、CH3CH2CH(CH3)CH2OH,
故选B.
点评 本题考查有机物的异构现象,为高频考点,把握醇的性质、烃基的结构为解答的关键,侧重分析与应用能力的考查,注意醇催化氧化的结构特点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届甘肃省高三上学期期中化学试卷(解析版) 题型:选择题
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A. | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B. | 铁比铜金属性强 | Fe腐蚀Cu刻制印刷电路板 |
C. | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
D. | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10种 | B. | 11种 | C. | 12种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
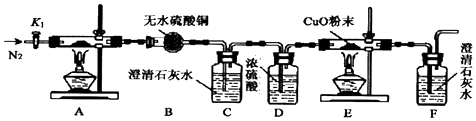
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应原理在科研和工农业生产中有广泛应用.
化学反应原理在科研和工农业生产中有广泛应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com