

分析 Ⅰ.(1)先计算氢气反应速率,再根据同一可逆反应同一段时间内各物质的反应速率之比等于其计量数之比计算二氧化碳平均反应速率;
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L)3 4 0 0
反应(mol/L)1 3 1 1
平衡(mol/L)2 1 1 1
化学平衡常数K=$\frac{c({H}_{2}O).c(C{H}_{3}OH)}{c(C{O}_{2}).{c}^{3}({H}_{2})}$;
(3)改变条件时,虚线I中,反应到达平衡时间缩短,氢气的含量升高,说明平衡逆向移动,且反应速率增大,应该是改变的温度;
虚线II中,氢气含量减小、缩短反应到达平衡时间,说明平衡正向移动且反应速率增大,改变的条件是增大压强;
Ⅱ.(1)甲醇燃料碱性电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子,电池反应式为2CH3OH+3O2+4OH-=2CO32-+6H2O,据此判断溶液pH变化;
(2)①正极上氧气得电子生成氧离子;
②放电时电解质中阴离子向负极移动.
解答 解:Ⅰ.(1)氢气反应速率=$\frac{\frac{8-2}{2}}{8}$mol•L-1•min-1=$\frac{3}{8}$mol•L-1•min-1,同一可逆反应同一段时间内各物质的反应速率之比等于其计量数之比得二氧化碳平均反应速率=$\frac{1}{3}$×$\frac{3}{8}$mol•L-1•min-1=0.125mol•L-1•min-1,
故答案为:0.125;
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L)3 4 0 0
反应(mol/L)1 3 1 1
平衡(mol/L)2 1 1 1
化学平衡常数K=$\frac{c({H}_{2}O).c(C{H}_{3}OH)}{c(C{O}_{2}).{c}^{3}({H}_{2})}$=$\frac{1×1}{{1}^{3}×2}$=0.5;
(3)改变条件时,虚线I中,反应到达平衡时间缩短,氢气的含量升高,说明平衡逆向移动,且反应速率增大,应该是升高温度;
虚线II中,氢气含量减小、缩短反应到达平衡时间,说明平衡正向移动且反应速率增大,改变的条件是增大压强,
故答案为:升高温度;增大压强;
Ⅱ.(1)甲醇燃料碱性电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,正极上氧气得电子和水反应生成氢氧根离子,电池反应式为2CH3OH+3O2+4OH-=2CO32-+6H2O,氢氧根离子参加反应导致溶液pH下降,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;下降;
(2)①正极上氧气得电子生成氧离子,电极反应式为O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
②放电时电解质中阴离子向负极移动,则氧离子向负极移动,故答案为:负.
点评 本题考查化学平衡计算、原电池原理,为高频考点,明确化学平衡计算中采用三段式法、原电池中正负极的判断及正负极上发生的反应是解本题关键,难点是电极反应式的书写,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 配制标准溶液的氢氧化钠中混有氯化钠杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 碱式滴定管尖嘴部分的气泡没全部赶跑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.4 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
| n(H2)(mol) | 1.2 | 1.05 | n1 | n2 | n2 | n2 |
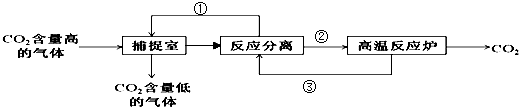
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
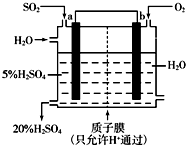 在硫酸工业中,SO2转化为SO3是一个关键步骤
在硫酸工业中,SO2转化为SO3是一个关键步骤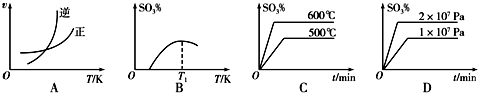
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:
2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:| A. | 氧化剂 | B. | 既是氧化剂又是还原剂 | ||
| C. | 还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
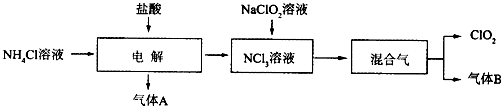
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com