
| A. | 合成洗涤剂和纯碱溶液都可洗去衣服上的油污,二者去污原理相同 | |
| B. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| C. | 发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统 | |
| D. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
分析 A.洗涤剂去污是乳化作用从而去污;纯碱水解显碱性,促进油污的水解;
B.Al(OH)3胶体具有较大的表面积,有吸附性;
C.减少含C化合物的使用,实现低碳排放;
D.大量燃烧化石燃料可产生有害气体和烟尘.
解答 解:A.洗涤剂去污是乳化作用从而去污;纯碱水解显碱性,促进油污的水解,从而去污,二者去污原理不相同,故A错误;
B.明矾在水中电离的铝离子能水解生成Al(OH)3胶体,Al(OH)3胶体具有较大的表面积,有吸附性,能吸附水中的悬浮物,可用于水的净化,故B正确;
C.减少含C化合物的使用,实现低碳排放,则推广可利用太阳能的城市照明系统有利于节能减排、改善环境质量,故C正确;
D.大量燃烧化石燃料可产生有害气体和烟尘,是造成雾霾天气的一种重要因素,故D正确.
故选A.
点评 本题考查了洗涤剂的去污原理、胶体的性质、雾霾的形成等,涉及知识点广,均为基础性知识,熟练掌握物质的性质和概念是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 46:9 | B. | 32:9 | C. | 23:9 | D. | 16:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (a-b) mL | B. | (25-a)mL | C. | (b-a)mL | D. | 大于a mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧能对水体消毒,是因为其能杀死水中的病菌 | |
| B. | 执行“限塑令”主要是为了节约资源 | |
| C. | 含磷洗涤剂因为其易被细菌分解,所以不会导致水体污染 | |
| D. | 新装修的住房中放置任何花卉都能降低居室中甲醛的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)的物质的量浓度 | B. | c(CH3COO-)的物质的量浓度 | ||
| C. | c (CH3COOH)/c(CH3COO-) | D. | c(H+)•c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
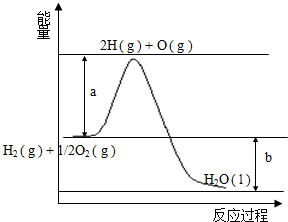 已知H2的燃烧热为285.8kJ•mol-1,反应过程中能量变化如图:请回答下列问题:
已知H2的燃烧热为285.8kJ•mol-1,反应过程中能量变化如图:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列有关叙述正确的是( )
,下列有关叙述正确的是( )| A. | 其单体是CH2=CH2和HCOOC2H5 | B. | 它是缩聚反应产物 | ||
| C. | 其链节是CH3CH2-COOC2H5 | D. | 其单体是CH2=CH-COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com