
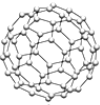
 氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料,已知C60中每个碳原子均达到8电子稳定结构.
氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料,已知C60中每个碳原子均达到8电子稳定结构.分析 ①C60分子中每个原子只跟相邻的3个原子形成共价键,且每个原子最外层都满足8电子稳定结构,则每个C形成的这3个键中,必然有1个双键,这样每个C原子最外层才满足8电子稳定结构,双键数应该是C原子数的一半,单键为σ键,1mol C60含30mol碳碳双键;
②C60中每个碳原子形成3个σ键,据此确定C原子杂化方式;
③熔点:原子晶体大于分子晶体,原子晶体熔点与共价键有关,分子晶体的熔点与共价键的键长无关.
解答 解:①C60分子中每个原子只跟相邻的3个原子形成共价键,且每个原子最外层都满足8电子稳定结构,则每个C形成的这3个键中,必然有1个双键,这样每个C原子最外层才满足8电子稳定结构,双键数应该是C原子数的一半,而双键中有1个σ键、1个π键,显然π键数目为30,一个C跟身边的3个C形成共价键,每条共价键只有一半属于这个C原子,所以σ键为$\frac{60×2}{2}$+30=90,每个C形成的这3个键中,必然有1个双键,1mol C60含30mol碳碳双键,加成消耗30mol氢气,质量为m=nM=60克,
故答案为:90;60;
②C60中每个碳原子形成3个σ键,所以C原子杂化方式为sp2,
故答案为:sp2;
③因为C60构成的晶体是分子晶体,影响分子晶体熔点的作用是分子间作用力;而金刚石构成的晶体是原子晶体,影响原子晶体熔点的作用是原子间共价键,共价键作用大大与分子间作用力,因此金刚石的熔点高于C60,所以尽管金刚石中C-C键的键长为154.45pm,C60中C-C键长为145~140pm,但其熔化时并不破坏化学键,因此比较键能没有意义,
故答案:C60是分子晶体,熔化时不需破坏化学键.
点评 本题考查了C60的有关知识,涉及σ键的计算、杂化类型判断、熔点比较等知识点,充分考查了学生灵活应用基础知识的能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a-c}{b-a}$ | B. | $\frac{a-c}{b-c}$ | C. | $\frac{a-b}{a-c}$ | D. | $\frac{b-c}{a-c}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、CaO、CO均为酸性氧化物 | |
| B. | 硫酸钡和水都是弱电解质 | |
| C. | 向煮沸的1mol•L-1 NaOH溶液中滴加饱和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com