
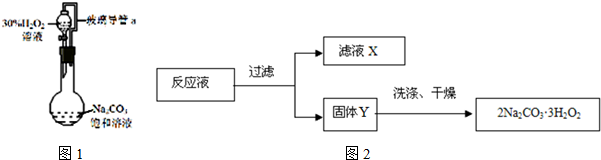
分析 本题是利用纯碱和过氧化氢制备过碳酸钠的实验操作与评价,既考查了反应原理,又考查了实验的注意点及混合物的分离与提纯,重点关注过碳酸钠(2Na2CO3•3H2O2)的性质,要防分解、防变质及提高产品产量与纯度,关于样品质量分数的计算可结合碳原子的守恒和固体质量和,以物质的量作为基本单位进行计算,据此解答;
(1)恒压滴液漏斗中的支管主要作用是保持压强平衡利于液体流下;
(2)此反应为放热反应,为防止过碳酸钠分解,可以通过控制反应速率和降温的方法来控制温度;
(3)①洗涤固体Y时选用无水乙醇作为洗涤剂,减少固体的溶解,同时还起到干燥的效果;
②根据溶解平衡的移动,增大钠离子浓度可促进过碳酸钠沉淀;
(4)a、Na2S会被过碳酸钠氧化;
b、醋酸和碳酸钠反应;
c、碳酸氢钠和过碳酸钠不反应;
(5)①沉淀反应是碳酸根离子利用加入氯化钡形成沉淀碳酸钡;
②沉淀法测定过碳酸钠质量分数需要称量样品质量和沉淀质量,计算得到过碳酸钠质量分数;
③样品的纯度可结合沉淀反应是否完全及过碳酸钠有无分解等角度考虑;
解答 解:(1)恒压滴液漏斗中的支管主要作用是保持压强平衡利于液体流下,故答案为:平衡压强,使H2O2溶液顺利流下;
(2)可以利用冰水混合物给反应容器降温,也可以调慢滴加过氧化氢的速度,故答案为:AB;
(3)①用乙醇洗涤过碳酸钠可减少固体的溶解,同时还能起干燥作用,故答案为:减少过碳酸钠的溶解损失,并带走水份利于干燥;
②滤液X中加入适量中加入适量NaCl固体,是为了增加钠离子浓度,促进过碳酸钠溶解平衡逆向移动,得到更多的沉淀,故答案为:增大钠离子浓度,降低过碳酸钠的溶解度;
(4)A、Na2S会被过碳酸钠氧化,使过碳酸钠失效,符合;
B、醋酸和碳酸钠反应,使过碳酸钠失效,符合;
C、碳酸氢钠和过碳酸钠不反应,不符合;
故答案为:AB;
(5)①样品中的碳酸钠加入氯化钡后滤液钡离子沉淀碳酸根离子,反应的离子方程式为:Ba2++CO32-=BaCO3↓,故答案为:Ba2++CO32-=BaCO3↓;
②实验过程中直接测定的物理量为样品的质量m1g、沉淀的质量m2g,沉淀物质的量=$\frac{{m}_{2}g}{197g/mol}$,设过碳酸钠物质的量为x,含有的碳酸钠物质的量为y,依据碳元素守恒得到2x+y=$\frac{{m}_{2}}{197}$、314x+106y=m1 ,x=$\frac{{m}_{1}-\frac{{m}_{2}×106}{197}}{102}mol$;过碳酸钠质量分数=$\frac{x×314}{a}=\frac{314({m}_{1}-\frac{106{m}_{2}}{197})}{102{m}_{1}}$,故答案为:$\frac{314({m}_{1}-\frac{106{m}_{2}}{197})}{102{m}_{1}}$.
③可能影响纯度分析的是沉淀时有没有将碳酸钠完全沉淀,或操作过程中有没有影响过碳酸钠的分解,故答案为:主要影响因素是沉淀是否完全及过碳酸钠有无分解.
点评 本题以物质制备为载体,考查了元素及化合物的知识,重视基础知识的检查,试题难度中等,主要难点是样品纯度计算,对学生分析问题解决问题的能力提高有帮助,还能促进学生关注双基的复习.


科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
(已知N2(g)+3H2(g)=2NH3(g) △H=-92. 4kJ·mol-1)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3的浓度( mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.2p1=2p3<p2 B.α2+α3<1
C.达到平衡时乙容器中NH3的体积分数最大 D.Q3+Q1>92.4
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
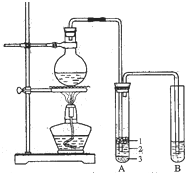 实验室制取少量溴乙烷的装置如图所示.
实验室制取少量溴乙烷的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨
A.有放射性 B易燃、易爆 C能导电 D 有剧毒
有剧毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com