
分析 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,B原子的最外层电子数是内层电子数的2.5倍,最外层最多含有8个电子,则B含有2个电子层,最外层含有5个电子,为N元素;A与C形成的常见化合物在常温下为液态,该化合物为H2O,则A为H、C为O元素;A与D、C与E分别同主族,D的原子序数大于O,则D为Na元素,E为S元素;F的原子序数大于S,应该为Cl元素,通过验证D、E、F同周期,满足条件,据此进行解答.
解答 解:(1)A为H元素,原子序数为1,位于周期表中第一周期IA族;D、E、F分别为Na、S、Cl元素,三种元素对应简单离子中,离子的电子层越多离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小,则离子半径最最大的为S2-,
故答案为:第一周期IA族;S2-;
(2)F的单质为氯气,氯气能与由A、C、D三种元素组成的一种常见化合物发生反应,该化合物为NaOH,该反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(3)非金属性越强,对应氢化物的稳定性越强,非金属性S<Cl,则二者最简单气态氢化物中稳定性较强的是HCl,
故答案为:HCl;
(4)BF3为NCl3,NCl3能发生水解反应生成一种弱碱和一种弱酸,水解产物中元素化合价不变,则弱碱为NH3•H2O,弱酸为HC1O,该反应的化学方程式为:NCl3+4H2O=NH3•H2O+3HC1O或NCl3+3H2O=NH3↑+3HC1O,
故答案为:NCl3+4H2O=NH3•H2O+3HC1O(或NCl3+3H2O=NH3↑+3HC1O).
点评 本题考查原子结构与元素周期律的应用,题目难度中等,推断元素为解答关键,注意掌握元素周期律内容、元素周期表结构,试题有利于提高学生的分析能力及综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 常温下1L 0.1 mol﹒L-1的Fe2(SO4)3溶液中含有0.2NA个Fe3+ | |
| B. | 相同质量的Na2O2和Na2S固体具有相同的阴阳离子数和质子数 | |
| C. | 用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L (不考虑氯气的溶解;电池工作时MnO2转化为MnOOH) | |
| D. | 常温下CH3COONH4的pH=7,则0.5 mol﹒L-1的CH3COONH4溶液中,NH4+浓度为0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中混有的SO2:用氢氧化钠溶液洗气 | |
| B. | 除去Cl2中混有的HCl:用饱和食盐水洗气 | |
| C. | 除去FeCl2溶液中混有的FeCl3:加入过量铜粉,过滤 | |
| D. | 除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2△H1>△H3 | B. | △H3=△H4+△H5 | C. | △H1=△H2+△H3 | D. | △H2<0,△H4<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +3 | B. | +2 | C. | +1 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol雄黄(As4S4,结构如图) 含有4NA个As-S键 含有4NA个As-S键 | |
| B. | 3.9 g Na2S和3.9 g Na2O2中含有的阴离子数目均为0.1NA | |
| C. | 1.8 g ${\;}_{8}^{18}$O2分子与1.8 g ${\;}_{8}^{18}$O3分子中含有的中子数目不相同 | |
| D. | 氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把氢氧化钠固体放在滤纸上称量 | |
| B. | 制取氯气时,将二氧化锰与浓盐酸加强热,用向下排气法收集氯气 | |
| C. | 配制0.1mol/L H2SO4溶液时,将量取的浓H2SO4放入容量瓶中稀释 | |
| D. | 做焰色反应时,每次实验前一定要用稀盐酸洗净铂丝,并在火焰上灼烧到没有颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制备Cl2 | B. | 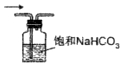 去除杂质 | C. |  干燥Cl2 | D. |  回收固体MnO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com