
【题目】以Cl2、NaOH、CO(NH2)2 (尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。

(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取Cl2时,阳极上产生也会产生少量的ClO2的电极反应式:________________________________;电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol。
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
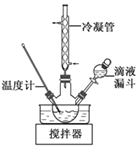
(3)步骤Ⅱ合成N2H4·H2O的装置如下图所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_________________;使用冷凝管的目的是_________________________________。
(4)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3,欲测定亚硫酸钠产品的纯度设计如下实验方案,并进行实验。准确称取所得亚硫酸钠样品m g于烧杯中,加入适量蒸馏水配成100 mL待测溶液。移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1酸性KMnO4标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(假设杂质不反应)。样品中亚硫酸钠的质量分数为__________(用含m、c、V的代数式表示)。某同学设计的下列滴定方式中,合理的是________(夹持部分略去)(填字母序号)

【答案】Cl--5e-+2H2O===ClO2↑+4H+ 0.01 3Cl2+6OH![]() 5Cl+ClO3+3H2O 缓慢通入Cl2 NaClO碱性溶液 减少水合肼的挥发 126cV/m% BC
5Cl+ClO3+3H2O 缓慢通入Cl2 NaClO碱性溶液 减少水合肼的挥发 126cV/m% BC
【解析】
(1)ClO2是电解饱和NaCl溶液的产物,因为a极通入NaCl饱和溶液,故a为阳极,b为阴极,阳极Cl-失去电子,被氧化,生成CLO2;在阴极2H2O+2e-=H2![]() OH-,生成112mlH2的同时,生成0.01molOH-,为保持溶液中的电荷守恒,则通过阳离子交换膜的阳离子为0.01mol;
OH-,生成112mlH2的同时,生成0.01molOH-,为保持溶液中的电荷守恒,则通过阳离子交换膜的阳离子为0.01mol;
(2)若温度超过40℃,Cl2与NaOH溶液,发生歧化反应,生成NaClO3、NaCl和水,因反应是放热反应,所以除冰水浴外,还可以采取缓慢通入氯气的方法控制温度;
(3)步骤Ⅱ中的反应为次氯酸钠碱性溶液与尿素水溶液反应制备水合肼,由于水合肼具有强还原性,能与次氯酸钠反应生成N2,为防止水合肼被氧化,应逐滴加入NaClO碱性溶液;NaClO碱性溶液与尿素水溶液在110![]() 继续反应,水合肼的沸点为118
继续反应,水合肼的沸点为118![]() ,使用冷凝管的目的是减少水合肼的挥发;
,使用冷凝管的目的是减少水合肼的挥发;
(4)依据2MnO4- + 6H+ + 5SO32- =2Mn2+ +5SO42-+3H2O,结合题中所给的数据计算亚硫酸钠的质量分数,并依试剂性质选择滴定方式;
(1)ClO2是电解饱和NaCl溶液的产物,因为a极通入NaCl饱和溶液,故a为阳极,b为阴极,阳极Cl-失去电子,被氧化,生成CLO2;阳极上产生ClO2的电极反应式:Cl--5e-+2H2O===ClO2↑+4H+;在阴极2H2O+2e-=H2![]() OH-,生成112mlH2的同时,生成0.01molOH-,为保持溶液中的电荷守恒,则通过阳离子交换膜的阳离子为0.01mol;
OH-,生成112mlH2的同时,生成0.01molOH-,为保持溶液中的电荷守恒,则通过阳离子交换膜的阳离子为0.01mol;
本题答案为:Cl--5e-+2H2O===ClO2↑+4H+,0.01。
(2)若温度超过40℃,Cl2与NaOH溶液,发生歧化反应,生成NaClO3、NaCl和水,离子方程式为:3Cl2+6OH![]() 5Cl+ClO3+3H2O;由于反应是放热反应,为了控制温度,除用冰水浴外,还可以缓慢的通入Cl2以控制温度;
5Cl+ClO3+3H2O;由于反应是放热反应,为了控制温度,除用冰水浴外,还可以缓慢的通入Cl2以控制温度;
本题答案为:3Cl2+6OH![]() 5Cl+ClO3+3H2O,缓慢的通入Cl2。
5Cl+ClO3+3H2O,缓慢的通入Cl2。
(3)步骤Ⅱ中,发生反应为次氯酸钠碱性溶液与尿素水溶液反应制备水合肼,由于水合肼具有强还原性,能与次氯酸钠反应生成N2,为防止水合肼被氧化,应逐滴加入NaClO碱性溶液,故通过分液漏斗滴加的是NaClO碱性溶液,NaClO碱性溶液与尿素水溶液在110![]() 继续反应,水合肼的沸点为118
继续反应,水合肼的沸点为118![]() ,使用冷凝管的目的是减少水合肼的挥发;
,使用冷凝管的目的是减少水合肼的挥发;
本题答案为:NaClO碱性溶液 减少水合肼的挥发。
(4)高锰酸钾和亚硫酸钠反应的离子方程式为2MnO4- + 6H+ + 5SO32- =2Mn2+ +5SO42-+3H2O,设mg样品中含有NaSO3的物质的量为x,,则有2:5=4cv![]() :x,,解得x=cv
:x,,解得x=cv![]() mol,所以NaSO3的质量分数为:
mol,所以NaSO3的质量分数为:![]() = 126cV/m%,因KMnO4显强氧化性,所以应选择酸式滴定管,Na2CO3是碱性试剂应选择碱式滴定管,所以BC滴定方式合理;
= 126cV/m%,因KMnO4显强氧化性,所以应选择酸式滴定管,Na2CO3是碱性试剂应选择碱式滴定管,所以BC滴定方式合理;
本题答案为:126cV/m%,B C。


科目:高中化学 来源: 题型:
【题目】下图是实验室对煤进行干馏的装置图,回答下列问题:

(1)指出图中仪器名称:c______,d______。
(2)仪器d的作用是______,c中液体有______和______,其中无机物里溶有_____,可用_____检验出来。有机物可以通过______的方法使其中的重要成分分离出来。
(3)e处点燃的气体的主要成分有_______,火焰的颜色为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列用途、性质或变化对应正确的是( )
A.利用粮食酿酒的化学过程包含:淀粉→葡萄糖→己醇
B.在月饼包装袋中放入生石灰:防止食物氧化变质
C.焰火的绚丽:说明只有金属单质能发生焰色反应
D.氢氧化铝用于治疗胃酸过多:氢氧化铝碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:1 mol晶体硅中含有2 mol Si—Si键。工业上可通过下列反应制取高纯硅:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
A.+412 kJ·mol-1 B.-412 kJ·mol-1
C.+236 kJ·mol-1 D.-236 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰)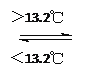 Sn (s、白);DH3=+2.1 kJ/mol
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是_________反应(填“吸热”、“放热”)。
(2)反应体系中加入催化剂对反应热是否有影响?___(填“有”、“无”),原因是_______。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 _______, E2 ______(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为_____,X的相对原子质量为_____。
(2)相同状况下,一定体积的气态氢化物H2X的质量是等体积NH3的2倍.则X的相对原子质量为_____。
(3)0.05mol 的硫酸钠中含有_____个氧原子;与_____g NaCl中所含有的Na+数目相同.
(4)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mLA受热完全分解生成15mLO2和10mL F2,则A的化学式为_____。
(5)0.5L 0.5mol/L FeCl3溶液中的Cl﹣的物质的量浓度为_____。
(6)质量分数为98%,密度为1.84g.cm﹣3的某浓硫酸,溶质的物质的量浓度为_____。
(7)a个X原子的总质量为b g,则X的相对原子质量可表示为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制和治理CO2是解决温室效应的有效途径。将CO2转化成有机物可有效实现碳循环,CO2转化成有机物的例子很多,如:
①6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
②CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
③CO2+CH4![]() CH3COOH
CH3COOH
④2CO2+6H2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
关于以上反应的说法,不正确的是( )
A. 反应①是最节能的,同时原子利用率最高
B. 反应①是最节能的,反应③的原子利用率最高
C. 在反应②中,CO2作为氧化剂
D. 反应④得到的产物可以作为生产塑料的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度/ (×10-3mol·L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①氨基甲酸铵分解反应的焓变△H__________0(填">"或"<)
②可以判断该分解反应已经达到化学平衡的是__________(填字母);
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为__________.
(2).已知25℃时,NH3·H2O电离常数Kb=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,计算0.5mol·L-1氨水的pH约为__________(已知lg3≈0.5)。在某MgCl2溶液中加入一定量的某浓度的氨水后,测得混合液的pH=11,则此温度下残留在溶液中的c(Mg2+)=__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com