
【题目】已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值与温度高低有关。当n(NaOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n(NaOH)=a mol时,下列有关说法错误的是
A. 参加反应的氯气的物质的量等于a/2 mol
B. 改变温度,产物中NaClO3的最大理论产量为a/7 mol
C. 改变温度,反应中转移电子的物质的量ne的范围:a/2 mol≤ne≤5a/6 mol
D. 若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]()
【答案】B
【解析】
A、产物NaC1、NaClO、NaClO3中,Na元素与Cl元素的物质的量之比均为1:1,所以加反应的氯气的物质的量为NaOH物质的量的1/2;B、改变温度,产物为NaC1O3和氯化钠,无有NaClO;C、假设发生反应1:Cl2+2NaOH=NaCl+NaClO+H2O,求出反应中转移电子的物质的量n(e-),假设发生反应2:3Cl2+6NaOH=5NaCl+NaClO3+3H2O,求出反应中转移电子的物质的量n(e-),据以上分析电子转移的范围;D、若反应后c(Cl-)/c(ClO-)=11,令NaC1、NaClO分别为11 mol、1 mol,据得失电子守恒可得NaC1O3为2 mol,最后可以计算出c(ClO-)/c(ClO3-)比值。
本题主要是考查氧化还原反应的相关计算,涉及极限法、原子守恒法等。
A、根据原子守恒n(NaOH)=amol=n(Na) =n(Cl) =2n(Cl2),则n(Cl2) =1/2amol,A正确;B、改变温度,产物中NaC1O3的最大理论产量即无NaClO生成,发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O,则NaC1O3的物质的量为1/6amol,B错误;C、当全部生成NaC1、NaClO时发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O,则 n(e-)=1/2amol,同理,当全部生成NaC1、NaClO3时发生的反应为3Cl2+6NaOH=5NaCl+NaClO3+3H2O,则 n(e-)=5/6amol,综上可得改变温度,反应中转移电子的物质的量n(e-)的范围:1/2amol≤ne≤5/6amol,C正确;D、若反应后c(Cl-)/c(ClO-)=11,令NaC1、NaClO分别为11 mol、1 mol,据得失电子守恒可得NaC1O3为2 mol,则溶液中c(ClO-)/c(ClO3-)=1/2,D正确;正确选项B。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】合乎实际并用于工业生产的是
A.金属钠在氯气中燃烧制氯化钠B.氢气和氯气混合经光照制氯化氢
C.氯气通入澄清石灰水中制漂白粉D.高温分解石灰石制生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒的化合物常用于制作催化剂和新型电池。回答下列问题:
(1)金属钒可由铝热反应制得。已知25℃、101 kPa时,
4A1(s)+3O2(g)=2Al2O3 (s) △H1=a kJ·mol-1
4V(s) +5O2 (g)=2V2O5(s) △H2=b kJ·mol-1
则用铝热反应冶炼金属V(s)的热化学方程式为_____________________。
⑵V2O5为橙黄至砖红色固体,无味、有毒,微溶于水,是许多有机和无机反应的催化剂。下图表示的是25℃时,部分含钒微粒的存在形式、浓度和存在的pH范围(其余可溶性微粒均未标出),图中“[V]”表示含钒微粒的浓度,虚线表示[V]或pH的范围尚未准确确定。
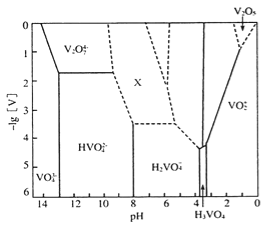
①V2O5溶于足量2mol L-1NaOH溶液中,发生反应的离子方程式为_________________,向反应后的溶液中,滴加硫酸溶液至过量(pH<1)的过程中,开始溶液保持澄淸,滴加一段时间后,观察到有橙黄色沉淀产生,继续滴加硫酸溶液,沉淀又消失。则沉淀消失过程中发生反应的化学方程式为_______________。
②上述滴加硫酸溶液的过程中,先后发生如下反应:

则“X所示区域溶液中的离子”不可能是___________(填序号);
a.V3O93- b.V4O103- c. V4O124-
(3)V2O5是反应2SO2+O2![]() 2SO3的催化剂。其他条件不变,加入V2O5后,该反应的速率加快的原因是_______________;恒温恒压下,加人V2O5,该反应的平衡常数________________ (填“增大”、 “减小”或“不变”);
2SO3的催化剂。其他条件不变,加入V2O5后,该反应的速率加快的原因是_______________;恒温恒压下,加人V2O5,该反应的平衡常数________________ (填“增大”、 “减小”或“不变”);
(4)下图所示为可充电的全钒液流电池构造示意图,该电池中的隔膜只允许H+通过。电池放电时,负极区溶液的pH将_____________(填“增大”、“减小”或“不变”),电池充电时,阳极的电极反应式为_____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某同学利用下列实验探究金属铝与铜盐溶液反应:

下列说法正确的是
A. 由实验1可以得出结论:金属铝的活泼性弱于金属铜
B. 溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
C. 实验2中生成红色物质的离子方程式:Al+Cu2+→Al3++Cu
D. 由上述实验可推知:用砂纸打磨后的铝片分别与c(H+)均为0.2 mol/L的盐酸和硫酸反应,后者更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了实验探究金属单质M与盐溶液的反应,某同学进行了下列实验,实验过程及实验现象如图所示,结合实验现象判断,该同学得出的下列结论中正确的是( )

A.向滤液中滴加盐酸的实验现象是产生白色沉淀
B.滤渣可能是两种金属单质的混合物
C.滤渣在足量的稀硝酸中能完全溶解
D.加入的金属M可能是镁或钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间能通过一步反应实现如图所示转化的是
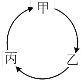
物质 选项 | 甲 | 乙 | 丙 |
A | SO2 | SO3 | H2SO4 |
B | NH4Cl | NH3 | NO |
C | Na2O | NaCl | NaOH |
D | Al(OH)3 | Al2O3 | AlCl3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有 Na2CO3、NaHCO3 和 NaCl 中的一种或多种。下列根据实验事实 得出的结论正确的是
A. 取一定量固体,溶解,向溶液中加入适量 CaO 粉末,充分反应后观察到有白色沉淀生成,说 明原固体中一定含有 Na2CO3
B. 取一定量固体,溶解,向溶液中通入足量的 CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3
C. 取一定量固体,溶解,向溶液中滴加适量 AgNO3 溶液,观察到有白色沉淀生成,说明原固体 中一定含有 NaCl
D. 称取 4.75 g 固体,加热至恒重,质量减少了 0.930 g。用足量稀盐酸溶解残留固体,充分反应 后,收集到 1.10 g 气体,说明原固体中含有 Na2CO3、NaHCO3 和 NaCl 三种,且它们的物质的 量之比为 1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物体内化合物的叙述,正确的是( )
A. 所有细胞中都含有蛋白质和磷脂
B. N是组成细胞内各种有机物的必需元素
C. 氨基酸脱水缩合产生水,水中的氢都来自氨基
D. 细胞核内的核酸只含脱氧核糖,细胞质中的核酸只含核糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,物质的量浓度均为0.1molL﹣1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)①中由水电离出的c(OH-)________(填“>”“=”或“<”)②中由水电离出的c(H+)。
(2)③中共存在______种粒子,pH=8.4的原因:_______________________________;
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
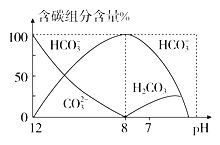
回答下列问题:
①当pH=7时,溶液中含碳元素的主要微粒为________
②已知在25 ℃时,CO![]() 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=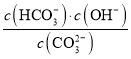 =2.0×10-4 mol·L-1,当溶液中c(HCO
=2.0×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=2∶1时,溶液的pH=______________。
)=2∶1时,溶液的pH=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com