
已知X、M都是中学教材中常见元素,下列对两个离子反应通式的推断中,其中正确的是
(甲)XO3n+Xn+H+--X单质+H2O(未配平);(乙)Mm++mOH-→M(OH)m↓
①若n=1,则XO3n中X元素为+5价,X位于周期表第VA族
②若n=2.则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m。
A.①③ B.②③ C.①② D.③④
科目:高中化学 来源:2015-2016学年北京顺义牛栏山一中高一上期中化学试卷(解析版) 题型:选择题
下列关于分散系的说法,正确是
A. 稀硫酸、盐酸、空气和水等都是分散系
B. 一般可用丁达尔现象区分溶液和浊液
C. 按稳定性由弱到强的顺序排列的是溶液、胶体、浊液(以水为分散剂时)
D. 按照分散质和分散剂的状态(气、液、固态),它们之间可以有9种组合方式
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二上10月月考化学试卷(解析版) 题型:选择题
SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需要吸收的能量分别为160 kJ、330 kJ,则S(s)+3F2(g)=SF6(g)的反应热ΔH为
A.-1528.6 kJ·mol-1 B.+1220 kJ·mol-1
C.-1220 kJ·mol-1 D.+1528.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省高二上期中(文)化学试卷(解析版) 题型:选择题
室内空气污染的主要来源之一是现代人生活中使用的化工产品,加泡沫绝缘材料的办公家具、化纤地毯、壁纸及书报、油漆等不同程度放出气体,该气体是
A.甲醛 B.乙烯 C.一氧化碳 D.甲烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则中学高二上12月月考化学试卷(解析版) 题型:选择题
下列关于化学反应的自发性叙述中正确的是( )
A.焓变小于0而熵变大于0的反应肯定是自发的
B.焓变和熵变都小于0的反应肯定是自发的
C.焓变和熵变都大于0的反应肯定是自发的
D.熵变小于0而焓变大于0的反应肯定是自发的
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:填空题
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
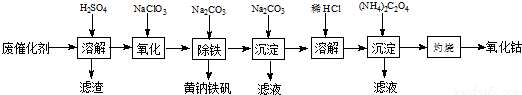
(1)溶【解析】
溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是_________________,所得滤渣的主要成分是_________(写化学式)。
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式_________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]•3H2O.
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是______________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式______________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是______________。
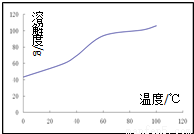
(5)溶【解析】
CoCl2的溶解度曲线如图所示向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是______________。
(6)灼烧:准确称取所得CoC2O4 1.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式_________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中测试化学试卷(解析版) 题型:选择题
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示,常温下,S2Cl2是种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl下列说法中错误的是
A.S2Cl2的结构式为Cl-S-S-Cl
B.反应中SO2是还原产物,S是氧化产物
C.S2Cl2为含有极性键和非极性键的分子
D.反应中,生成1molSO2,转移电子为3mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上11月月考化学试卷(解析版) 题型:填空题
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16 g。试回答下列问题。
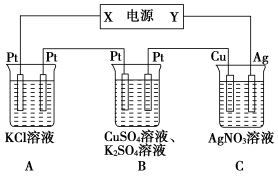
(1)电源中X电极为直流电源的________极。
(2)pH变化:A:________,B:________,C:________。(填“增大”、“减小”或“不变”)
(3)通电5 min时,B中共收集224 mL (标准状况下) 气体,溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(假设电解前后溶液体积无变化)。
(4)若A中KCl足量且溶液的体积也是200 mL,电解后,溶液的pH为________(假设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高一上半期测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.直径介于1 nm~100 nm之间的微粒称为胶体
B.制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸
C.胶体与浊液的本质区别是其稳定性,胶体属于介稳体系
D.利用丁达尔效应可以区分溶液和胶体溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com