
| A. | 二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ | |
| B. | 硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3•H2O+H2O | |
| C. | 碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3•H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
分析 A.铁离子具有氧化性,能够将二氧化硫氧化成硫酸;
B.氢氧化钠少量,氢离子结合氢氧根离子能力大于铵根离子,所以氢离子优先反应,铵根离子不参与反应;
C.离子方程式两边负电荷不相等,违反了电荷守恒;
D.强碱性溶液中,反应产物中应该生成水,不会生成氢离子.
解答 解:A.二氧化硫通入氯化铁溶液,二者发生氧化还原反应,反应的离子方程式为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,故A正确;
B.硫酸氢铵溶液中滴加少量NaOH溶液,氢离子结合氢离子能力大于铵根离子,只有氢离子反应,正确的离子方程式为:H++OH-=H2O,故B错误;
C.碱性条件下铝粉还原NaNO2,离子方程式必须满足电荷守恒,正确的离子方程式为:NO2-+2Al+OH-+2H2O=2AlO2-+NH3•H2O,故C错误;
D.强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,强碱性溶液中不会生成氢离子,正确的离子方程式为:3ClO-+4OH-+2Fe(OH)3=2FeO42-+3Cl-+5H2O,故D错误;
故选A.
点评 本题考查考查离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断的常用方法,如:离子方程式两边是否满足电荷守恒、电子守恒、质量守恒定律等,还要注意反应环境,如D中碱性溶液中产物不会存在氢离子.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:选择题

| A. | 分子中含有2种官能团 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
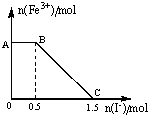 将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )
将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )| A. | 图中AB段发生的是过量的酸性KMnO4溶液与KI的反应 | |
| B. | 从题中可以得出还原性:I->Fe2+>Mn2+ | |
| C. | 取B点以后的少量溶液滴入几滴KSCN溶液,溶液变红色 | |
| D. | 根据OC段的数据可知,开始加入的KMnO4的物质的量为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
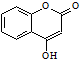 是一种医药中间体.常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体.常用来制备抗凝血药,可通过下列路线合成:

 和乙醇为原料,制备
和乙醇为原料,制备  的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
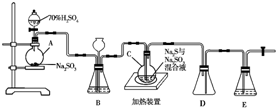 工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下:
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{△}{→}$
$\stackrel{△}{→}$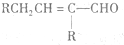 兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸
兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸 合成兔耳草醛的路线如下:
合成兔耳草醛的路线如下:
 、
、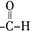 (写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热
(写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热 .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图1装置除去HCl中少量的Cl2 | |
| B. |  用图2装置蒸干Al2(SO4)3饱和溶液制取无水Al2(SO4)3 | |
| C. |  图3制备并收集少量NO2 | |
| D. |  图4是原电池装置,Fe电极为阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com