
对反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4的下列说法正确的是
A.该反应的氧化剂只有CuSO4
B.SO42-既不是氧化产物也不是还原产物
C.1 mol CuSO4还原了 mol的S
mol的S
D.被还原的S和被氧化的S的质量比为7:3
D
【解析】
试题分析:A、根据方程式可知硫酸铜中铜元素的化合价从+2价降低到+1价,得到1个电子,硫酸铜是氧化剂。FeS2中S元素的化合价从-1价部分升高到+6价,失去7个电子,做还原剂。部分从-1价降低到-2价,做氧化剂,A不正确;B、部分SO42-是氧化产物,B不正确;C、硫酸铜是氧化剂,因此1 mol CuSO4氧化了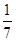 mol的S,C不正确;D、根据方程式和电子得失守恒可知,14mol硫酸铜氧化1mol FeS2。另外4mol FeS2中有3.5mol是氧化剂,0.5mol是还原剂,所以被还原的S和被氧化的S的质量比=3.5×2:(0.5×2+1×2)=7:3,D正确,答案选D。
mol的S,C不正确;D、根据方程式和电子得失守恒可知,14mol硫酸铜氧化1mol FeS2。另外4mol FeS2中有3.5mol是氧化剂,0.5mol是还原剂,所以被还原的S和被氧化的S的质量比=3.5×2:(0.5×2+1×2)=7:3,D正确,答案选D。
考点:考查氧化还原反应的有关判断和计算


科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的氧化剂只有CuSO4 | ||
| B、SO42-既不是氧化产物也不是还原产物 | ||
C、1 mol CuSO4还原了
| ||
| D、被还原的S和被氧化的S的质量比为7:3 |
查看答案和解析>>
科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:021
对反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列结论正确的是
[ ]
A.只有CuSO4作氧化剂
B.FeS2既是氧化剂又是还原剂
C.被氧化的硫和被还原的硫的质量之比为3∶7
D.1mol CuSO4可以氧化5/7mol硫元素
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com