
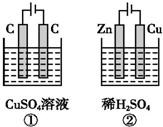
 如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A. | 产生气体的总体积:①>② | |
| B. | 电极上析出物质的总质量:②>① | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | ①中阳极的电极反应式:4OH--4e-═2H2O+O2↑;②中阴极的电极反应式:2H++2e-═H2↑ |
分析 ①、②有外接电源,都是电解池,①中阳极反应为4OH--4e-=O2↑+2H2O,阴极反应为:Cu2++2e-=Cu,②中阳极发生Zn-2e-=Zn2+,阴极发生2H++2e-=H2↑,以此解答该题.
解答 解:A.①的阳极反应:4OH--4e-=O2↑+2H2O,导线中通过0.02mol电子时,产生氧气的体积V=nVm=0.02mol×$\frac{1}{4}$×22.4L/mol=0.0112L,②中的正极反应为2H++2e-=H2↑,导线中通过0.02mol电子时,产生氢气的体积V=nVm=0.02mol×$\frac{1}{2}$×22.4L/mol=0.0224L,所以产生气体的体积:①≠②,故A错误;
B.①右边电极阴极生成铜,反应为:Cu2++2e-=Cu;②右边电极为正极生成氢气,反应为2H++2e-=H2↑,则导线中均通过0.02mol电子,所以电极上析出物质的物质的量:①=②,故B错误;
C.①相当于电解硫酸铜,溶液的pH减小,②相当于锌和硫酸中的氢离子反应,所以氢离子减少,酸性减弱,所以pH增大,故C错误;
D.由分析可知,①中阳极反应为4OH--4e-=O2↑+2H2O,②中阴极发生2H++2e-=H2↑,故D正确.
故选D.
点评 本题综合考查原电池和电解池知识,题目注意把握电极反应的判断和电极方程式的书写,为解答该题的关键,题目难度中等.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 灼烧白色粉末,直接观察火焰颜色 | 火焰呈黄色 | 原粉末中有Na+无K+ |
| B | 将一块Al箔在酒精灯火焰上灼烧 | Al箔熔融而不滴落 | Al2O3具有较高的熔点 |
| C | 将一小块Na放入硫酸铜溶液中 | 有铜单质析出 | Na能置换出硫酸铜中的铜 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水的反应 | |
| B. | 灼热的炭与二氧化碳反应生成一氧化碳 | |
| C. | 高炉炼铁 | |
| D. | 氢氧化钠溶液与稀盐酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
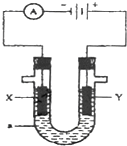 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉是混合物,有效成分是CaCl2 | |
| B. | 光照氯水有气泡逸出,该气体是Cl2 | |
| C. | Cl2能使湿润的有色布条褪色,说明Cl2具有漂白性 | |
| D. | 实验室用二氧化锰与浓盐酸反应制取Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极:2H++2e-═H2↑阳极:4OH--4e-═2H2O+O2↑ | |
| B. | 阴极:2H++2e-═H2↑阳极:2Cl--2e-═Cl2↑ | |
| C. | 阴极:Cu2++2e-═Cu阳极:4OH--4e-═2H2O+O2↑ | |
| D. | 阴极:Cu2++2e-═Cu阳极:2Cl--=2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素B的单质与化合物A2D反应能生成D的单质 | |
| B. | 工业上利用铝热反应可制得单质C | |
| C. | 原子B、C、D半径的大小顺序:D>C>B | |
| D. | 一定条件下,过量的B单质与D单质直接生成BD3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
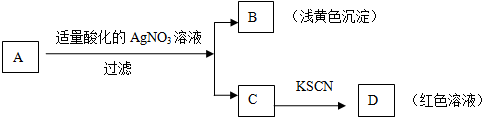
| A. | 盐A一定是FeBr3 | B. | 浅黄色沉淀B是AgBr | ||
| C. | 滤液C中一定含Fe 3+ | D. | D溶液中有Fe(SCN)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com