
����Ŀ����֪����2H2(g)+O2(g)=2H2O(l);��H=��572kJ/mol
��2H2(g)+O2(g)=2H2O(g);��H=��484kJ/mol
��CH4(g)+2O2(g)=2H2O(l)+CO2(g);��H=��890kJ/mol
��1����֪H-H�ļ���436kJ/molO=O�ļ���496kJ/molH-O�ļ���463kJ/mol�������������ݼ����٢���һ����Ӧ����ͨ������ֱ�Ӽ���ó� ��������д����Ӧ H2O ( l ) = H2O ( g )���ʱ��H= ��
��2���������ɼ���CO2��g��+4H2( g ) =CH4( g ) +2H2O( g )���ʱ��H= ��
��3���ڢ٢ڢ���������ʽ����һ����ȼ���ȵ��Ȼ�ѧ����ʽ �����Ӧ����ʽ����ţ���״���£�ȡ����������Ļ������11.2 L��ȫȼ�պ�ָ������£���ų�������Ϊ263.8kJ�������������м������������� ��
���𰸡���1���� +44 kJ��mol-1 ����2����H=-166 kJ��mol-1 ����3���� 2:3
��������
�����������1��������ָ���³�ѹ�£���1mol������Ӳ��������̬ԭ������Ҫ��������������֪H-H�ļ���436kJ/mol O=O�ļ���496kJ/mol H-O�ļ���463kJ/mol��ֻ�ܼ�����������������ˮ�����ķ�Ӧ�ȣ�����ֻ�ܼ��㷴Ӧ�ڵ��ʱ䣬��֪��Ӧ��2H2 ( g ) + O2 ( g ) = 2H2O ( l ) ��H1 = ��572 kJ/mol����Ӧ��2H2 ( g ) + O2 ( g ) = 2H2O ( g ) ��H 2= ��484kJ/mol�����ݸ�˹�����ɣ���-�٣�/2�ã�H2O ( l ) = H2O ( g ) ��H=����H 2-��H1��/2=����484kJ/mol+572 kJ/mol��/2=+44 kJ��mol-1��
��2����֪��Ӧ��CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); ��H3 = ��890 kJ/mol�����ݸ�˹���ɣ���Ӧ��+��-�۵÷�Ӧ��CO2��g��+4H2( g ) =CH4( g ) +2H2O( g ) ��H=����H1 +��H 2��- ��H3=����572 kJ/mol��484kJ/mol��-����890 kJ/mol��=-166 kJ��mol-1��
��3��ȼ������1mol��ȼ����ȫȼ������1mol�ȶ�������ų�������������̼Ԫ��ȼ�յIJ��������CO2(g)����Ԫ�ر�����Һ̬��ˮ���ڢ٢ڢ���������ʽ��ֻ�Тٲ���ȼ���ȵ��Ȼ�ѧ����ʽ����״���£�ȡ����������Ļ������11.2 L��ȫȼ�պ�ָ������£���ų�������Ϊ263.8kJ�����������ʵ���Ϊxmol�����������ʵ���Ϊymol��![]() ��x=0.2mol �� y=0.3mol����������м�������������Ϊ2:3��
��x=0.2mol �� y=0.3mol����������м�������������Ϊ2:3��


 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ��ö��Ե缫�����������Һ��������������ռ����װ����ͼ��ʾ�����ͬ��ͬѹ�£�����ס��ҵ������ԼΪ1��2������˵������ȷ����( )

A��a�����Դ�ĸ�������
B��b�缫��Ӧʽ��2H2O��4e���� O2����4H��
C�����ӽ���Ĥc��d��Ϊ�����ӽ���Ĥ
D�������Ϊ������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A������ˮ���Ĵ������D��ʳ����Ҫ�ɷ֡���ص�ת����ϵ���£�
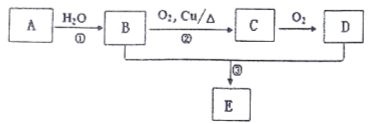
��ش��������⣺
��1��A�Ľṹ��ʽΪ ����Ӧ���ķ�Ӧ������ ��
��2��C�������� ��
��3����Ӧ���Ļ�ѧ����ʽΪ ���÷�Ӧ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ԭ�ӵ�������a g��12Cԭ�ӵ�������b g����NA��ʾ����٤��������ֵ������˵����ȷ����
A������ԭ�ӵ����ԭ������Ϊ![]()
B��mg����ԭ�ӵ����ʵ���Ϊ![]()
C������ԭ�ӵ�Ħ������ΪaNAg
D��ag����ԭ�������ĵ�����Ϊ17mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϸ���Ľṹ������������ʻ����ǹ���ϸ���ĸ��ֻ���������й���Щ�����﹦�ܵ���������ȷ����
A. ��������ɵ����ʵ���
B. ��������ȱ������ˮ�����ȷ�
C. ������ֲ��ϸ������Դ����
D. ������Ŵ�������DNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һЩ�����ĵ��ʣ�������֮���ת����ϵͼ����Щ��Ӧ�еIJ������ʱ���ȥ�����³�ѹ�£�AΪ��ɫ�ж����壬BΪ����ɫ��ĩ��C��EΪ�������ʡ���Ӧ�٢ھ�Ϊ��ҵ�ϵ���Ҫ��Ӧ��

��ش��������⣺
��1��D�ĵ���ʽΪ__ ___��
��2��K�Ļ�ѧʽΪ___ ___��
��3��д��B��C���·�Ӧ����E��F�Ļ�ѧ����ʽ��___ __��
��4��д��D��J��ϡ��Һ��Ӧ����G�����ӷ���ʽ��__ ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ̽��ѧϰС��ͬѧ�ú���������������ҪΪ������ɳ��CaCl2��MgCl2��Na2SO4�����Ĵ�����ȡ����ѧ��������NaCl��ʵ��ǰ������������·�������ͼ����

��1����д�������ڢܡ��ݲ������Լ����Ƽ��ڢ��������ƣ�
��_________����_________����_________��
��2��д���ڢݲ������п��ܷ�����Ӧ�Ļ�ѧ����ʽ��________________________��
��3����������������ڢݲ�ʵ���Ƿ�ﵽ��Ŀ�ģ�________________________��
��4������Ϊ���������Щ���������Ӱ��ʵ������____________________________��
��5����ͬѧ��Ϊ����ʵ����Ʋ�����Լ����������һ�����룺_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ��ǿ������,����������������ȡ�
��1��O3��KI��Һ��Ӧ���ɵ����ֵ����� �� (�����ʽ)��
��2����֪��̫������ֽ�ˮ���⣺2H2O(l)��2H2(g)+O2(g)��H1=+571.6kJ��mol�C1
����̿��ˮ��Ӧ���⣺C(s)+H2O(g)��CO(g)+H2(g)��H2=+131.3kJ��mol�C1
��������ˮ��Ӧ���⣺CH4(g)+H2O(g)��CO(g)+3H2(g)��H3=+206.1kJ��mol�C1
��ӦCH4(g)��C(s)+2H2(g)����H= kJ��mol�C1
��3��O3��ˮ���ֽ�,һ��������,O3��Ũ�ȼ���һ�������ʱ��(t)�����ʾ����֪:O3����ʼŨ��Ϊ 0.021 6 mol/L��
pH t /min T/�� | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
��pH�����ܼ���O3�ֽ�,������O3�ֽ�������õ��� ��
����30 ����pH=4.0������,O3�ķֽ�����Ϊ mol/(L��min)��
���ݱ��еĵݱ����,�Ʋ�O3�����������·ֽ��������������˳��Ϊ (����ĸ)��
A��40 ����pH=3.0 B��10 ����pH=4.0 C��30 ����pH=7.0
��4��O3���ɳ���������(ԭ����ͼ)���ϡ�����Ƶá�

��ͼ������Ϊ (����A������B��),��缫��ӦʽΪ ��
����C��ͨ��O2,��A���ĵ缫��ӦʽΪ ��
����C����ͨ��O2,D��E���ֱ��ռ���x L��y L����(��״��),��E���ռ���������O3��ռ���������Ϊ ��(����O3�ķֽ�)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ����������
A��pH=l����Һ�У�CH3CH2OH��Cr2O72����K+��SO42��
B��NaHCO3��Һ����![]() ��CO32����Br����K��
��CO32����Br����K��
C���������۷ų�����H2����Һ�У�Fe2+��K+��Cl����NO3��
D��C��Ca2+��=0.1 mol��L��1����Һ�У�NH4+��SO42-��CH3COO����Br-
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com