
下列说法不正确的是( )
A.臭氧(O3)是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水的消毒剂
B.人造纤维可利用竹子、棉花、麻类的纤维材料制成,而合成纤维是利用自然界的非纤维材料(如石油、煤)通过化学合成方法得到
C.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单
D.有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH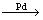
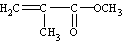 ,其过程符合绿色化学的原则
,其过程符合绿色化学的原则
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g) 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
D.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
假设19.2g Cu与足量的稀硝酸完全反应,试回答:
(1)写出铜与稀硝酸反应的化学方程式
(2)反应后生成硝酸铜的物质的量
(3)参加反应的稀硝酸的物质的量
(4)标准状况下,生成NO气体的体积
(5)被还原硝酸的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某酯的分子式为C6H12O2,其变化如图所示:
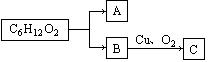
若A能发生银镜反应,C不能发生银镜反应,则该酯的可能结构有 种。
(2)将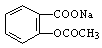 转变为
转变为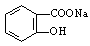 的流程为
的流程为
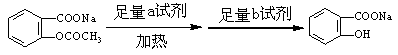
则a试剂是 ,b试剂是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。

已知:

(1)A分子中的官能团名称是_______、_______。
(2)A的一种同分异构体属于乙酸酯,其结构简式是________________
(3)B转化为C的化学方程式是________________________________________,其反应类型是_______。
II.用烃C或苯合成PMLA的路线如下。
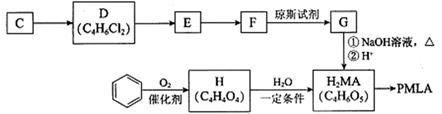
已知:

(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,H有顺反异构,其反式结构简式是________________
(5)E的结构简式是________________
(6)G与NaOH溶液在加热条件下反应的化学方程式是_________________________
(7)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种)________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是 ( )
A X与Y形成化合物是,X可以显负价,Y显正价
B 第一电离能可能Y大于X
C 最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D 气态氢化物的稳定性:HmY小于HnX
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
| ||||||||||||||||
|
| ② |
| ③ | ④ | ⑤ | ⑥ |
| ||||||||||
|
| ⑦ |
| ⑧ |
|
|
|
| ||||||||||
|
|
|
|
|
| ⑨ |
|
|
|
| ⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑤的轨道表示式_______,元素⑨原子的核外电子排布式__________。
(2)元素第一电离能的大小比较:④_____⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④_____⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式_________。
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
(4)上述③与④元素组成的(CN)2化合物中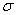 键与
键与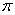 键之比________。
键之比________。
(5)⑦的氧化物是优良的耐高温材料,它的熔点比 CaO高,其原因是_____________。
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式________。
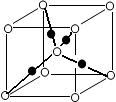
查看答案和解析>>
科目:高中化学 来源: 题型:
洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。

下列有关说法不正确的是
A .从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程
.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程
B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
C.在过程③⑤中溴元素均被氧化
D.过程①中除去粗盐中的SO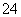 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.分子中键能越大,键长越长,则分子越稳定
B.P4和CH4都是正四面体分子且键角都为109o28ˊ
C.在化学反应中,某元素由化合态变为游离态,该元素被还原
D.电子层结构相同的不同离子,其半径随核电荷数增多而减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com