
| A����ӦZ2+2A2+=2A3++2Z�����Խ��� |
| B��ZԪ���ڢٷ�Ӧ�б��������ڢ۷�Ӧ�б���ԭ |
| C����ԭ����ǿ������˳����Z����B����A2+��X2+ |
| D����������ǿ������˳����XO4����Z2��B2��A3+ |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ʵ��֤�������ԣ�MnO4-��Cl2��Fe3����I2 |
| B������ʵ���У���������������ԭ��Ӧ |
| C��ʵ������ɵ����岻��ʹʪ��ĵ���KI��ֽ���� |
| D��ʵ���֤��Fe2���������������л�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | �μӷ�Ӧ������ | ������ |
| �� | KMnO4 ��H2O2 ��H2SO4 | K2SO4 ��MnSO4���� |
| �� | Cl2 ��FeBr2 | FeCl3��FeBr3 |
| �� | MnO4�� ���� | Cl2 ��Mn2+ ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��8��0 mol?L��1 | B��0��12 mol?L��1 |
| C��0�� 8 mol?L��1 | D��1��2 mol?L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��7��4 | B��7��3 | C��7��2 | D��7��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaCl | B��NaCl��NaBr | C��NaCl��NaBr��NaI | D��NaCl��NaI |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����

| ʵ����� | ʵ������ | ���� |
| ����a����Բ����ƿ�е�������Ũ���Ȼ��رջ���a����ȼ�ƾ��ơ� | Dװ���У���Һ��� Eװ���У�ˮ����Һ��ƣ� ��CCl4�������Ա仯�� | Cl2��Br2��Fe3+����������ǿ������˳��Ϊ�� |
| ����(SCN)2������±�ص������ơ������ԣ�Cl2��(SCN)2�� ����Cl2��Br2��Ӧ����BrCl�����ʺ�ɫ���Դ���ɫ�����е�Լ5�棬��ˮ����ˮ�ⷴӦ�� ����AgClO��AgBrO��������ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

A����Һ�в����ܷ�����Ӧ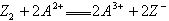 |
| B��Z2Ԫ���ڣ�1����3����Ӧ�о�����ԭ�� |
C����������ǿ����˳����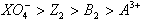 |
| D��X2+��XO4��ԭ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
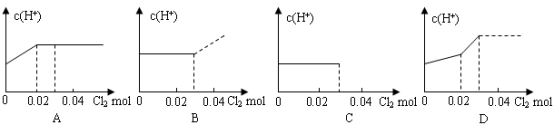
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com