
| A. | 已知X在一定条件下转化为Y,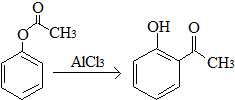 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 | |
| B. | 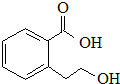 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 | |
| C. | 淀粉、蛋白质最终的水解产物都只有一种 | |
| D. | 香柠檬粉具有抗氧化功能,结构为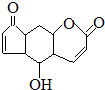 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH |
分析 A.酚可以和铁盐发生显色反应;
B.该物质中含有苯环、醇羟基、羧基,具有苯、醇和羧酸性质;
C.淀粉最终水解生成葡萄糖,蛋白质最终生成氨基酸,但氨基酸都多种结构;
D.该物质中能和溴发生反应的只有碳碳双键,能和氢氧化钠反应的有酯基水解生成的羧基.
解答 解:A.酚可以和铁盐发生显色反应,X不含酚羟基、Y含有酚羟基,所以Y能和氯化铁发生显色反应,但X不能发生显色反应,所以可以用氯化铁鉴别,故A正确;
B.该物质中含有苯环、醇羟基、羧基,具有苯、醇和羧酸性质,能发生加成反应、取代反应、消去反应、缩聚反应、酯化反应,但不能发生水解反应,故B错误;
C.淀粉最终水解生成葡萄糖,蛋白质最终生成氨基酸,但氨基酸都多种结构,所以蛋白质最终水解产物不一定是一种,故C错误;
D.该物质中能和溴发生反应的只有碳碳双键,能和氢氧化钠反应的有酯基水解生成的羧基,所以它与溴水发生反应,1mol最多消耗2molBr2,它与NaOH溶液反应,1mol最多消耗1molNaOH,故D错误;
故选A.
点评 本题考查物质结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酚、羧酸、醇及烯烃性质,易错选项是D,注意该物质中不含酚羟基,没有酚的性质,为易错题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
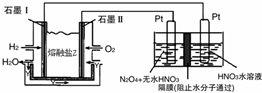 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1)2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,立即用水喷洒 | |
| B. | 大量氯气泄漏时,迅速离开现场,并尽量往高处去 | |
| C. | 不慎洒出的酒精在桌上着火时,立即用大量水扑灭 | |
| D. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开汽水瓶.有气泡从溶液中冒出 | |
| B. | H2、I2、HI混合气体加压后颜色变深 | |
| C. | 实验室中常用排饱和食盐水的方法收集 | |
| D. | 合成氨工业采用高压条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
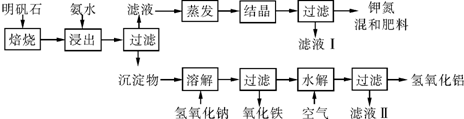
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
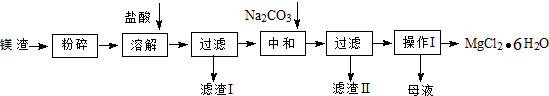
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
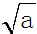 mol•L-1.
mol•L-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com