
【题目】氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下(反应条件省略):

(1)![]() 的化学名称是__________________,核磁共振氢谱有______种不同化学环境的氢。
的化学名称是__________________,核磁共振氢谱有______种不同化学环境的氢。
(2)反应①所需要试剂为_________________________________。
(3)反应③的反应类型是_________________________________。
(4)反应④的化学方程式为_________________________________。
(5)C的分子式为_________________________________。
(6) 的同分异构体中,含有相同官能团,且为1,3,5—三取代苯结构的有6种,其中4种结构如右图所示:
的同分异构体中,含有相同官能团,且为1,3,5—三取代苯结构的有6种,其中4种结构如右图所示:
请写出另外两种同分异构体的结构简式:_________________________________。
【答案】 甲苯 4 浓HNO3、浓H2SO4 氧化反应 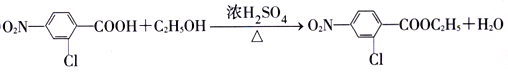 C13H17O4N2Cl
C13H17O4N2Cl 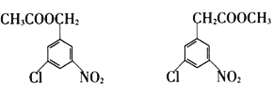
【解析】(1)![]() 的化学名称是甲苯,由于苯环对称,所以核磁共振氢谱有4种不同化学环境的氢。(2)根据反应②的生成物结构简式可判断A是对甲基硝基苯,所以反应①是硝化反应,所需要试剂为浓HNO3、浓H2SO4。(3)反应③是高锰酸钾氧化甲基为羧基,其反应类型是氧化反应。(4)反应④是B中的羧基与乙醇发生酯化反应,所以反应的化学方程式为
的化学名称是甲苯,由于苯环对称,所以核磁共振氢谱有4种不同化学环境的氢。(2)根据反应②的生成物结构简式可判断A是对甲基硝基苯,所以反应①是硝化反应,所需要试剂为浓HNO3、浓H2SO4。(3)反应③是高锰酸钾氧化甲基为羧基,其反应类型是氧化反应。(4)反应④是B中的羧基与乙醇发生酯化反应,所以反应的化学方程式为![]() 。(5)由于反应⑤是酯交换反应,所以C的结构简式为
。(5)由于反应⑤是酯交换反应,所以C的结构简式为![]() ,则C的分子式为C13H17O4N2Cl。(6)根据所给的四种结构简式可判断氯原子和硝基不变,变化的是酯基的结构,因此另外两种同分异构体的结构简式为
,则C的分子式为C13H17O4N2Cl。(6)根据所给的四种结构简式可判断氯原子和硝基不变,变化的是酯基的结构,因此另外两种同分异构体的结构简式为 。
。


科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是_________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________________。
(4)过程Ⅲ实验的目的是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是一种常用的治感冒药,其结构简式如图所示,下列有关阿司匹林的说法正确的是

A. 1mol阿司匹林最多能与5mol H2反应
B. 1mol阿司匹林最多能与1molNaHCO3反应
C. 1mol阿司匹林最多能与2mol NaOH反应
D. 1mol阿司匹林与足量的Na反应生成ImolH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯(Pd)可作汽车尾气CO、NO和HC(碳氢化合物)转化的催化剂。Pd负载量不同或不同工艺制备的纳米Pd对汽车尾气处理的结果如下图所示。下列说法不正确的是

A. 图甲表明,其他条件相同时,三种尾气的转化率随Pd负载量的增大先升后降
B. 图乙表明,尾气的起燃温度随Pd负载量的增大先降后升
C. 图甲和图乙表明,Pd负载量越大催化剂活性越高
D. 图丙和图丁表明,工艺2制得的催化剂Pd的性能优于工艺1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如右图所示(EMI+为有机阳离子)。

①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH1=a kJ·mol-1
②3AlCl(g)===2Al(l)+AlCl3(g) ΔH2=b kJ·mol-1
③Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3
下列说法正确的是( )
A. ΔH3<0
B. Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3=(a-b) kJ·mol-1
C. 该电池充电时石墨电极与电源负极相连
D. 该电池放电时的负极反应方程式为Al-3e-+7AlCl===4Al2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为4L的密闭容器中,发生如下反应:2A(g)+B(g)![]() C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
(1)用生成物C表示20s内的平均反应速率为_________________mol/(L·s)。
(2)反应前A的物质的量浓度是________________mol/L。
(3)反应达平衡时,B的转化率为________________ 。
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
编号 | 改变的条件 | D的生成速率 |
① | 降低体系温度 | ______ |
② | 恒容下补充A气体 | ______ |
③ | 恒容下充入Ne(不参与体系反应) | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮酸钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体。已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |

(1)制备NaN3:
30℃时,水合肼(N2H4H2O)与亚硝酸甲酯(CH3ONO)、NaOH反应,装置如右图所示。反应后锥形瓶中混合物经“操作X”可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。
①装置中的多孔球泡的作用是______。
②写出生成NaN3的化学方程式:_________________。
③“操作X”的名称为________________。
(2)测定NaN3产品纯度: ①称取NaN3产品5.0000g,用适量稀硫酸溶解后配成100.00mL溶液A;②取25.00mL溶液A,加入20.00mL0.2000mol/LKMnO4溶液,得紫红色溶液B;
③向溶液B加入足量KI溶液消耗过量的KMnO4溶液,然后以淀粉作指示剂,用0.1000mol/LNa2S2O3标准溶液滴定产生的I2,消耗Na2S2O3溶液30.00mL。测定过程中物质的转化关系如下:
10NaN3+2KMnO4+8H2SO4=2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑
I- ![]() I2
I2 ![]() S4O62-
S4O62-
计算NaN3产品的纯度(写出计算过程)。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲苯的实验事实中,能说明侧链对苯环性质有影响的是:
A.甲苯通过硝化反应生成三硝基甲苯 B.甲苯能使酸性高锰酸钾溶液褪色
C.甲苯燃烧时产生浓烈的黑烟 D.1mol甲苯可与3mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3 是一种重要的化工原料,工业上用 H2、N2合成。
(1)工业上由焦炭或天然气制氢气的过程中会产生一氧化碳。为了尽量除去氢气中混有的 一氧化碳,可在催化剂存在的条件下发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。
CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。
①在一个容积为 2L 的恒温密闭容器中加入 1molCO 和 3molH2O(g),发生上述反应,5min 后达到平衡,测得放出热量为 20.5kJ,则该时间段内反应的平均速率ν(CO)=______,此温度下该反应平衡常数 K=_____。该温度下在此容器中加入 3molCO 和 1molH2O(g)发生上述反应,达到平衡后放出热 量_____20.5kJ(填“>”、“=”或“<”)。
②已知不同反应物投料比(![]() )下,平衡混合气体中 CO 的体积分数如下表所示:
)下,平衡混合气体中 CO 的体积分数如下表所示:
温度(℃)\投料比 | 1 | 3 | 5 |
200℃ | 0.70 | 0.21 | 0.02 |
从表中数据分析可知:
反应物投料比越大,CO 的平衡转化率越________(填“大”或“小”); 请推测随反应物投料比增大,H2O的平衡转化率的变化趋势是______(填字母)。
A.增大 B.减小 C.先减小后增大 D.先增大后减小
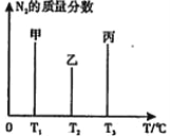
(2)用 2mol N2和3molH2合成氨,三容器的反应温度分别为 T1、T2、T3且恒定不变,在 其它条件相同的情况下,实验测得反应均进行到t min时N2的质量分数如图所示,此时甲、乙、丙三个容器中一定达到化学平衡状态的是_____,都达到平衡状态时,N2转化率最低的是________。(用“甲”、“乙”、“丙”填空)
(3)NH3与CO2在120℃,催化剂作用下可以合成反应生成尿素: CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
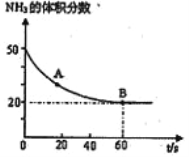
A 点的逆反应速率V逆(CO2)_____B 点的正反应速率 V正(CO2)(填“>”、 “=”或“<”);NH3的平衡转化率为____________。
(4)已知 NH2COONH4(s)![]() 2NH3(g)+CO2(g),若将一量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1____________P2, ρ1_____________________ρ2(填“>”、“=”或“<”)。
2NH3(g)+CO2(g),若将一量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1____________P2, ρ1_____________________ρ2(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com