
����Ŀ��������M{ [(CH3COO)2Cr]2��2H2O����Է�������Ϊ376}��������ˮ���dz��õ��������ռ���ʵ��������п��������������Һ����������Һ������Ϊ��Ҫԭ���Ʊ��û������װ����ͼ��ʾ��������2��Ԥ�ȼ���п������֪���۸����ȶ������ױ���������������п��Ӧ���Ʊ������з�������ط�Ӧ���£�
Zn(s)+2HCl(aq)�TZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)�T2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)�T[Cr(CH3COO)2]22H2O(s)

��ش��������⣺
��1������1��������__________��
��2��������2�м���������Ȼ�����Һ��˳�������__________������ţ���Ŀ����______________________________��
A.��������Ȼ�����Һͬʱ����
B.�ȼ����Ȼ�����Һ��һ��ʱ����ټ�����
C.�ȼ����ᣬһ��ʱ����ټ����Ȼ�����Һ
��3��Ϊʹ���ɵ�CrCl2��Һ���������Һ˳����ϣ�Ӧ�رշ���__________���A����B������ͬ��������___________________��
��4����ʵ����п��Ҫ��������ԭ������ò�����H2��CrCl2��Һѹ��װ��3���������Һ��Ӧ�⣬��һ��������__________________________��
��5����֪������Ӧ��������ʵ��ʱȡ�õ�CrCl3��Һ�к�����9.51g��ȡ�õĴ�������ҺΪ1.5L0.1mol/L��ʵ���ø��﴿����[Cr(CH3COO)2]22H2O 9.024g�����ʵ�����ò�Ʒ�IJ���Ϊ__________���������ܽ��M����
��6���������ӻ���Ⱦˮ��������Ҫ��ȥ����ʵ���ж����Cr2+���������Һ��ͨ��������________���ټ����Һ������pH����Ϊ________����ʹ�������ӳ�����ȫ(��������Ũ��ӦС��10-5mol/L)������֪Cr(OH)3���ܶȻ�Ϊ6.3��10-31��![]() =4��lg2��0.3��
=4��lg2��0.3��
���𰸡���Һ©�� C ��п���������ᷴӦ����������H2��װ��2��װ��3�еĿ����ų�����ֹ���ɵ�Cr2+������ B A ������Zn��Cr3+��ֻ�ԭΪCr2+ 80.0% ��0.80 ���������� 5.6
��������
���⿼�������Ʊ�ʵ�鷽������ơ�
��1�����������ṹ�������ж�����1�����ơ�
��2�����۸����ȶ������ױ�������������п���������ȷ�Ӧ����H2����װ��2��3�еĿ����ϳ���
��3����������������ʹװ��������ѹǿ����CrCl2��Һѹ��װ��3����CH3COONa��Һ˳����ϡ�
��4��������п��CrCl3��ַ�Ӧ�õ�CrCl2
��5��CrCl3Ϊ0.06mol���õ�CrCl2Ϊ0.06mol����CH3COONaΪ0.15mol���ɷ���ʽ��֪CH3COONa����������CrCl2����[Cr(CH3COO)2]2��2H2O�����۲�����������������ʡ�
��6�����۸����׳�ȥ���ɽ������������ȥ������Ksp[Cr��OH��3]=c��Cr3+����c3��OH-���Լ�KW=c��H+����c��OH-������pH���ɡ�
��1����ͼ��֪������1�������Ƿ�Һ©����
��2�����۸����ȶ������ױ�������������п���������ȷ�Ӧ����H2����װ��2��3�еĿ����ϳ����������ɵ��Ǹ����ӱ����������ȼ�����һ��ʱ����ټ����Ȼ�����Һ����ѡC��
��3��Ϊʹ���ɵ�CrCl2��Һ��CH3COONa��Һ˳����ϣ�Ӧ�رշ���B������A��
��4����ʵ����п��Ҫ��������ԭ������ò�����H2��CrCl2��Һѹ��װ��3��CH3COONa��Һ��Ӧ�⣬��һ��������ʹп��CrCl3��ַ�Ӧ�õ�CrCl2��
��5��CrCl3�����ʵ���Ϊ��![]() =0.06mol���õ�CrCl2Ϊ0.06mol����CH3COONaΪ0.15mol���ɷ���ʽ��֪CH3COONa��������õ�[Cr(CH3COO)2]2��2H2OΪ0.06mol��
=0.06mol���õ�CrCl2Ϊ0.06mol����CH3COONaΪ0.15mol���ɷ���ʽ��֪CH3COONa��������õ�[Cr(CH3COO)2]2��2H2OΪ0.06mol��![]() ��376g/mol=11.28g�����ò�Ʒ�IJ���Ϊ��
��376g/mol=11.28g�����ò�Ʒ�IJ���Ϊ��![]() ��100%=80.0%��
��100%=80.0%��
��6�����Һ��ͨ�������Ŀ�������������Cr2+����ΪCr3+���������ӳ�����ȫʱ��Ũ��ӦС��10-5mol/L������Ksp[Cr��OH��3]=c��Cr3+����c3��OH-��=6.3��10-31����ʱ��Һ��c��OH-��=4��10-9mol/L����ҺpH=-lgc��H+��=![]() =5.6��
=5.6��


 �żӾ���ϵ�д�
�żӾ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ԫ���У�ԭ�Ӱ뾶�����������
A.Li��K��RbB.I��Br��ClC.O��Na��SD.Al��Si��P
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʷ����˵������ȷ����
A. ���ʯ���������ڵ��� B. Ư�ۡ����������ڻ����
C. �Ȼ�李����������ڵ���� D. ��������ͭ�����ںϽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС����̽��̼����Ԫ�صķǽ����Ե����ǿ����ʵ��װ�����£�

��1������a������Ϊ______��
��2��Bװ����ʢ�ŵ��Լ���______��C�з�����Ӧ�Ļ�ѧ����ʽΪ_______��
��3��ͨ��______����ʵ���������ж�̼�ķǽ�����ǿ�ڹ�ķǽ����ԡ��������оٳ�һ����ʵ��˵��̼�ķǽ�����ǿ�ڹ�ķǽ����ԣ�______��
��4����С���һλͬѧ��Ϊ�����ô�ʵ��װ�ü�ҩƷ��Ҳ����֤���ǽ�����Cl>C>Si,���Ƿ�ͬ���ͬѧ�Ĺ۵㣿___������ͬ����������ͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ���仯�����ڹ�ũҵ������Ӧ�ù㷺��
I.��֪��þ����Ҫ�ɷ�ΪMg2B2O5H2O����ɰ�Ļ�ѧʽΪNa2B4O710H2O��һ��������þ����ȡ����þ������Ĺ�������������ʾ��

��1����ɰ��BԪ�صĻ��ϼ�Ϊ_______������ɰ������ˮ�������������Һ��pHΪ2��3����ȡH3BO3���÷�Ӧ�����ӷ���ʽΪ____________________��XΪH3BO3���������ˮ�IJ������Mg��Ӧ��ȡ����Ļ�ѧ����ʽΪ_____________��
��2����MgCl2��7H2O�Ʊ�MgCl2ʱ����Ҫ��HC1��Χ�м��ȣ���Ŀ����________��
��3��þ-H2O2����ȼ�ϵ�صķ�Ӧԭ��ΪMg+H2O2+2H+==Mg2++2H2O�������£�����ʼ�������ҺpH=1����pH=2ʱ���������Һ������Mg2+�����ʵ���Ũ��Ϊ_____________mol��L-1����֪���¶��£�Ksp[Mg(OH)2]=5.6��10-12�����������Һ��pH=6ʱ��_______(��С����ޡ�)Mg(OH)2���������������Է�Ӧ��������Һ������仯��
II.��ҵ�Ͽ�������MgH2��LiBH4��ɵ���ϵ�����⣬��ͼ��ʾ��

��4��д����������з�����Ӧ�Ļ�ѧ����ʽ��____________��
III. MgO��Һ��һ�ָ��Ե���������������ѳ������е�SO2����������Ҫ��Ӧ���£�
��Mg(OH)2��SO2===MgSO3��H2O
��MgSO3+SO2��H2O===Mg(HSO3)2
��Mg(HSO3)2+Mg��OH��2===2MgSO3��2H2O
��2MgSO3��O2===2MgSO4
��֪25��ʱ��Kap��MgSO3��=3.86��10-3��Kap��CaSO3��=3.1��10-7��
��5������������ͬʱ��þ���ƻ�������Ч����Һ����Ħ�������ȵı仯�����ͼ��ʾ��þ��������Ч���ܱȸƻ��Ĵ����ɵ�MgSO4�������õ�ˮ�����⣬����Ϊ_____________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о��绯ѧ��ʴ��������װ������ͼ��ʾ�������й�˵���������

A. dΪп�飬��Ƭ���ױ���ʴ
B. dΪп�飬��Ƭ�ϵ缫��ӦΪ2H����2e��==H2��
C. dΪʯī����Ƭ��ʴ�ӿ�
D. dΪʯī��ʯī�ϵ缫��ӦΪO2��2H2O��4e��==4OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ҹ涨����2001��2��1����ȫ��ֹͣ������ Ǧ���ͣ�������Ǧ���͡���Ǧ���͵ĺ�����
A.�����о��Բ���ǦԪ��B.�����в�����Ϊ���ӵĺ�ǦԪ�ص�����
C.�����к�ǦԪ����һ��ָ�귶Χ֮��D.���϶�����ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�ֳ��õ�����������ͼ���������̿���Ҫ�ɷ�ΪMnO2���Ʊ�������ص�һ�ֹ��գ������в��ֲ�������ȥ����

������ʲ�ͬ�¶��µ��ܽ�ȣ���λ��g�����������
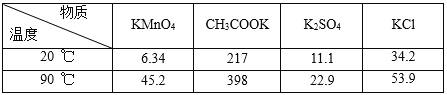
��1�������ڡ����跴Ӧ�Ļ�ѧ����ʽΪ_____��
��2��K2MnO4��Һ�м�������ᷢ����Ӧ�����ӷ���ʽΪ��_____��
��3������2��_____��_____��_____��
��4��ͼ�п���ֱ�ӽ���ѭ�����õ�������_____���ѧʽ����
��5��KMnO4�־����е���Ҫ���ʣ��ѧʽ����_____��_____�������������ͼ�еı����ᣬ���µ����⼰ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�4g H2��11.2L O2��1mol H2O�У�����������������______����ԭ����������________������������________�������С����________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com